よむ、つかう、まなぶ。
再生医療等の安全性の確保等に関する法律に基づく再生医療等に関連した「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」に基づく手続等について[582KB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
立しており、科学的妥当性が確認された医療技術として部会において確認されることが
前提であることから、部会における予備的な適合性確認がなされたのちに第一種使用規
程の申請を開始すること。
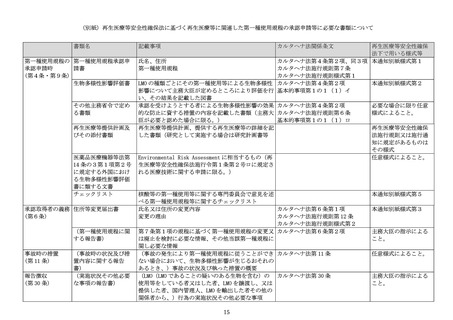
(3) 個別の医療技術として第一種使用規程を評価する場合のプロセスについて
核酸等を用いる再生医療等に関連してカルタヘナ法に規定される第一種使用規程に該当
するものの実施に関する学識経験者の意見聴取(以下「評価」という。)については、部
会の下に設置された核酸等の第一種使用等に関する専門委員会(以下「カルタヘナ委員会」
という。)において実施し、カルタヘナ委員会における評価の後、部会において改めて再
生医療等提供計画との整合性の確認を行う。
申請された第一種使用規程については、カルタヘナ委員会が別途定める核酸等の第一種
使用等に関する専門委員会で意見を述べる第一種使用規程等に関するチェックリスト(別
紙様式第5。以下「チェックリスト」という。)に基づき、評価の前提条件の確認を行う。
前提条件を満たしていることが確認された場合、カルタヘナ委員会における評価を実施す
る。
ただし、臨床研究として実施する計画であって特定認定再生医療等委員会における適合
性の確認と並行してカルタヘナ法の第一種使用規程の承認申請を開始した場合に、当該特
定認定再生医療等委員会の意見により以下に定める第一種使用規程に関する申請書等の記
載事項に変更が生じたときは、変更内容についてカルタヘナ委員会での評価を再度行う必
要が生じうることから、変更点の比較表を作成して再度申請を行う必要がある点に留意す
ること。
1) 承認申請にあたっての留意点
第一種使用規程の承認申請にあたっては、次の点に留意すること。
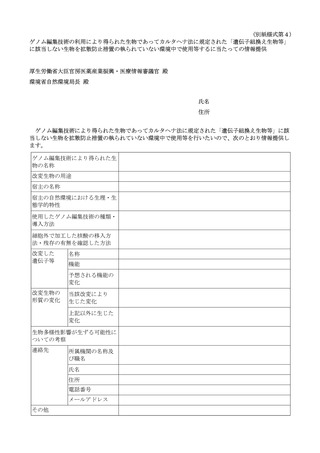
ア. 以下に掲げる書類(以下「申請書等」という。)を作成し、主務大臣に提出して
申請すること。
再生医療等提供計画及びその添付書類
第一種使用規程承認申請書
生物多様性影響評価書
生物多様性影響の効果的な防止に資する措置の内容を記載した書類(必要な
場合に限る。)
チェックリスト
イ. 「再生医療等提供計画及びその添付書類」については、以下に示す書類とするこ
と。
再生医療等提供計画(様式第1又は様式第1の2)
提供する再生医療等の詳細を記した書類(研究として実施する場合は研究計
画書)
5
前提であることから、部会における予備的な適合性確認がなされたのちに第一種使用規
程の申請を開始すること。
(3) 個別の医療技術として第一種使用規程を評価する場合のプロセスについて
核酸等を用いる再生医療等に関連してカルタヘナ法に規定される第一種使用規程に該当
するものの実施に関する学識経験者の意見聴取(以下「評価」という。)については、部
会の下に設置された核酸等の第一種使用等に関する専門委員会(以下「カルタヘナ委員会」
という。)において実施し、カルタヘナ委員会における評価の後、部会において改めて再
生医療等提供計画との整合性の確認を行う。
申請された第一種使用規程については、カルタヘナ委員会が別途定める核酸等の第一種
使用等に関する専門委員会で意見を述べる第一種使用規程等に関するチェックリスト(別
紙様式第5。以下「チェックリスト」という。)に基づき、評価の前提条件の確認を行う。
前提条件を満たしていることが確認された場合、カルタヘナ委員会における評価を実施す
る。
ただし、臨床研究として実施する計画であって特定認定再生医療等委員会における適合
性の確認と並行してカルタヘナ法の第一種使用規程の承認申請を開始した場合に、当該特
定認定再生医療等委員会の意見により以下に定める第一種使用規程に関する申請書等の記
載事項に変更が生じたときは、変更内容についてカルタヘナ委員会での評価を再度行う必
要が生じうることから、変更点の比較表を作成して再度申請を行う必要がある点に留意す
ること。
1) 承認申請にあたっての留意点
第一種使用規程の承認申請にあたっては、次の点に留意すること。
ア. 以下に掲げる書類(以下「申請書等」という。)を作成し、主務大臣に提出して
申請すること。
再生医療等提供計画及びその添付書類
第一種使用規程承認申請書
生物多様性影響評価書
生物多様性影響の効果的な防止に資する措置の内容を記載した書類(必要な
場合に限る。)
チェックリスト
イ. 「再生医療等提供計画及びその添付書類」については、以下に示す書類とするこ
と。
再生医療等提供計画(様式第1又は様式第1の2)
提供する再生医療等の詳細を記した書類(研究として実施する場合は研究計
画書)
5