よむ、つかう、まなぶ。
05資料3MRワクチン(ミールビックⅡ)の定期接種における使用について(報告)[1.4MB] (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59303.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会(第68回 7/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
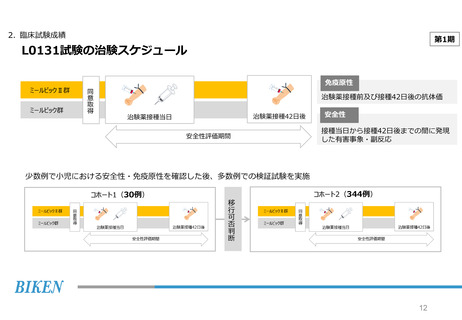
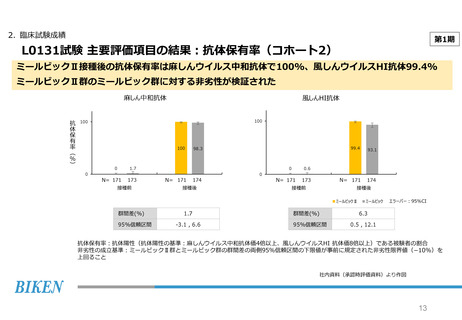
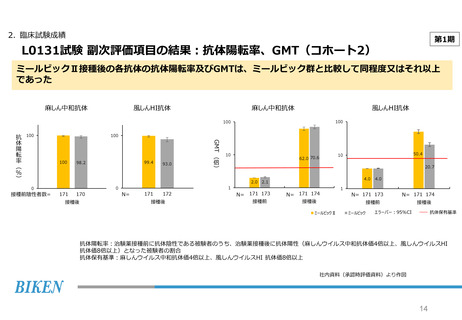
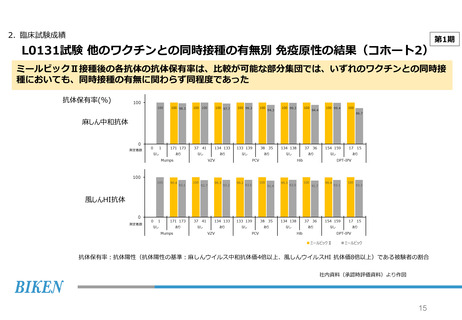
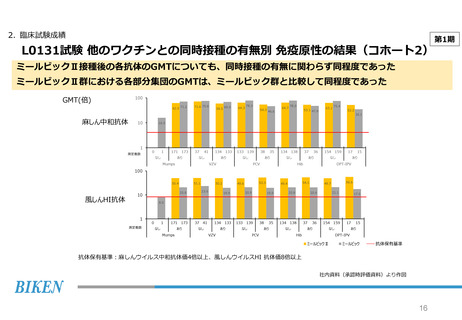
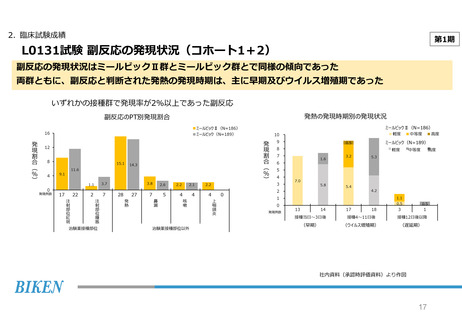
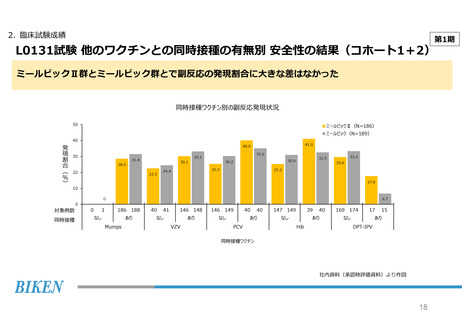
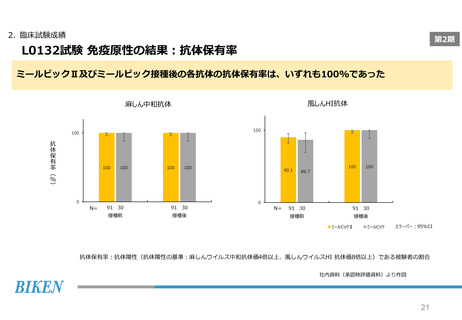
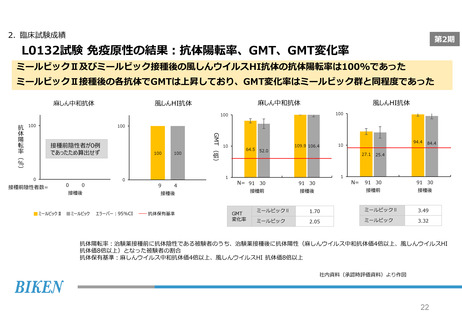
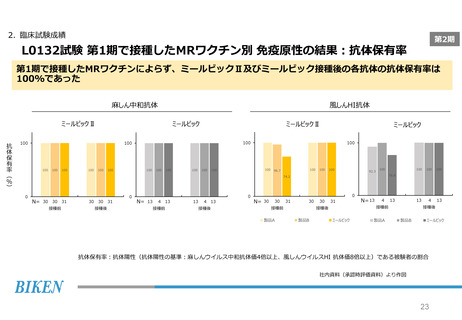
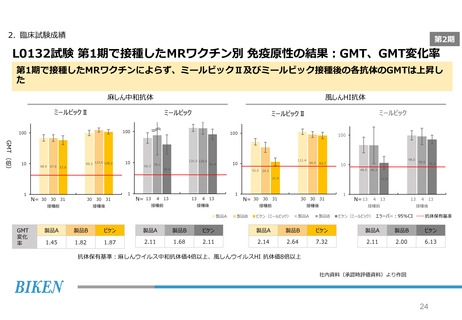
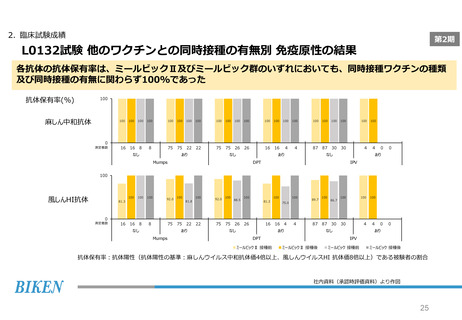
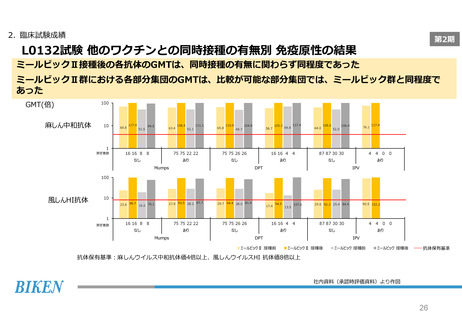
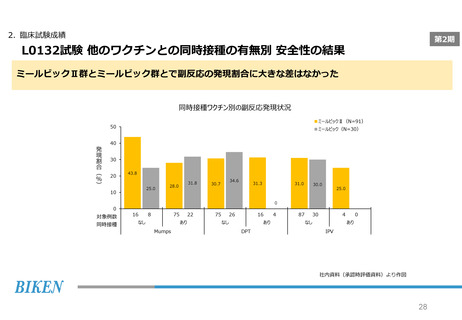
2. 臨床試験成績
第2期
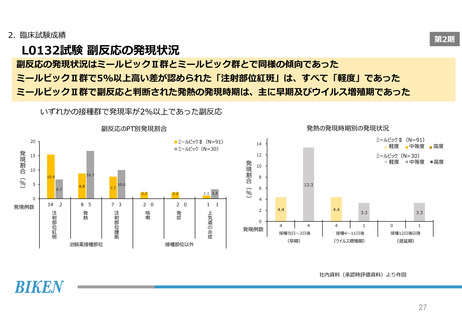
L0132試験 副反応の発現状況
副反応の発現状況はミールビックⅡ群とミールビック群とで同様の傾向であった
ミールビックⅡ群で5%以上高い差が認められた「注射部位紅斑」は、すべて「軽度」であった
ミールビックⅡ群で副反応と判断された発熱の発現時期は、主に早期及びウイルス増殖期であった
いずれかの接種群で発現率が2%以上であった副反応
発熱の発現時期別の発現状況
副反応のPT別発現割合
ミールビックⅡ(N=91)
20
発
現
割
合
(
%
)
14
ミールビック(N=30)
12
15
10
16.7
15.4
5
6.7
8.8
7.7
10.0
2.2
2.2
1.1 3.3
0
発現例数
14
注
射
部
位
紅
斑
2
8
5
発
熱
治験薬接種部位
7
3
注
射
部
位
腫
脹
2
咳
嗽
0
2
0
発
疹
接種部位以外
1
上
気
道
の
炎
症
1
発
現
割
合
(
%
)
10
ミールビックⅡ(N=91)
軽度
中等度
高度
ミールビック(N=30)
軽度
中等度
高度
8
13.3
6
4
2
0
発現例数
4.4
4.4
4
4
4
3.3
1
3.3
0
1
接種当日~3日後
接種4~11日後
接種12日後以降
(早期)
(ウイルス増殖期)
(遅延期)
社内資料(承認時評価資料)より作図
27
第2期
L0132試験 副反応の発現状況
副反応の発現状況はミールビックⅡ群とミールビック群とで同様の傾向であった
ミールビックⅡ群で5%以上高い差が認められた「注射部位紅斑」は、すべて「軽度」であった
ミールビックⅡ群で副反応と判断された発熱の発現時期は、主に早期及びウイルス増殖期であった
いずれかの接種群で発現率が2%以上であった副反応
発熱の発現時期別の発現状況
副反応のPT別発現割合
ミールビックⅡ(N=91)
20
発
現
割
合
(
%
)
14
ミールビック(N=30)
12
15
10
16.7
15.4
5
6.7
8.8
7.7
10.0
2.2
2.2
1.1 3.3
0
発現例数
14
注
射
部
位
紅
斑
2
8
5
発
熱
治験薬接種部位
7
3
注
射
部
位
腫
脹
2
咳
嗽
0
2
0
発
疹
接種部位以外
1
上
気
道
の
炎
症
1
発
現
割
合
(
%
)
10
ミールビックⅡ(N=91)
軽度
中等度
高度
ミールビック(N=30)
軽度
中等度
高度
8
13.3
6
4
2
0
発現例数
4.4
4.4
4
4
4
3.3
1
3.3
0
1
接種当日~3日後
接種4~11日後
接種12日後以降
(早期)
(ウイルス増殖期)
(遅延期)
社内資料(承認時評価資料)より作図
27