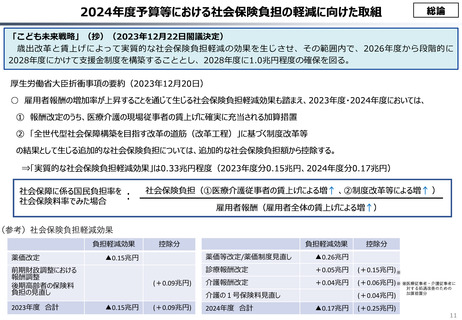
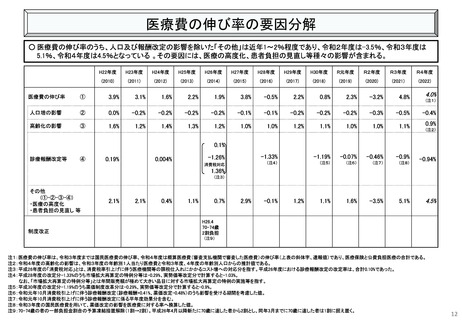
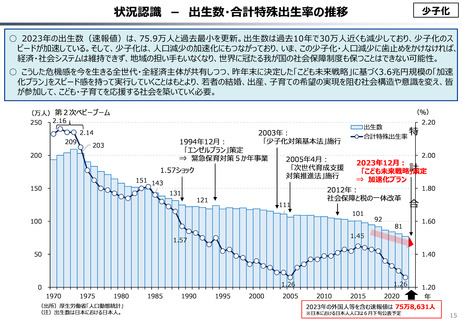
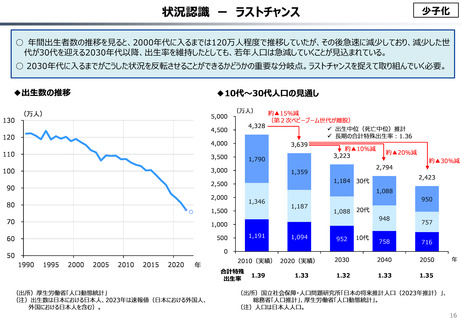
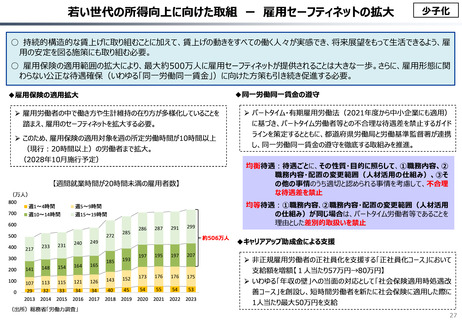
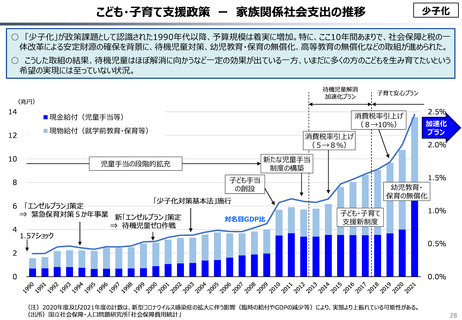
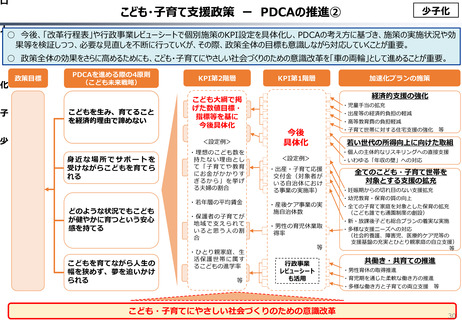
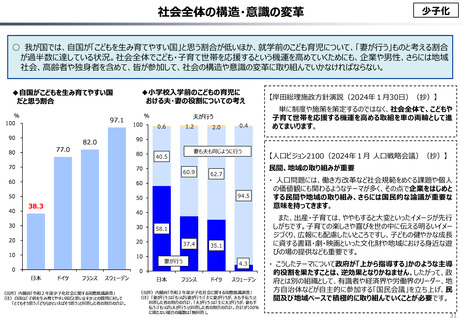
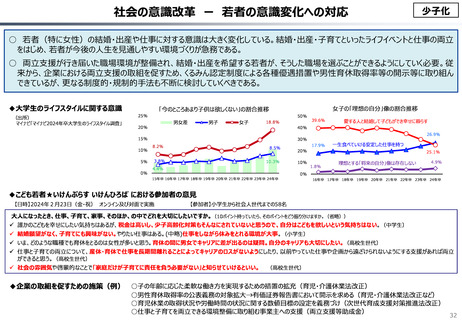
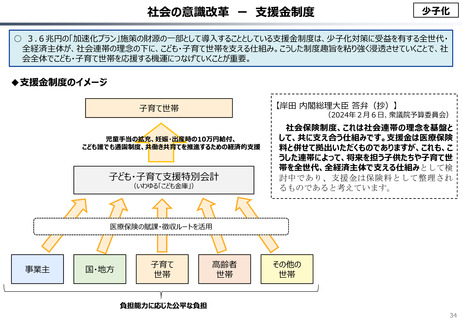
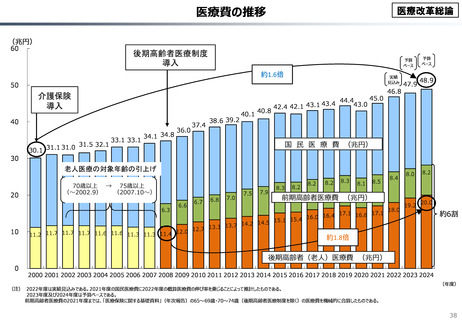
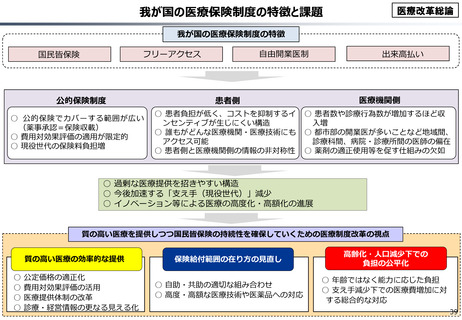
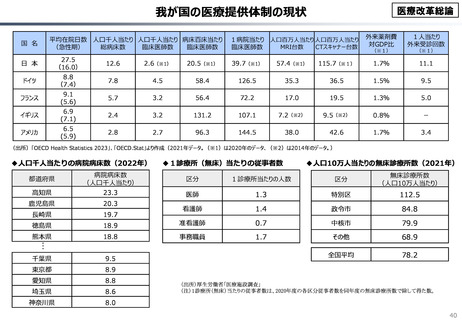
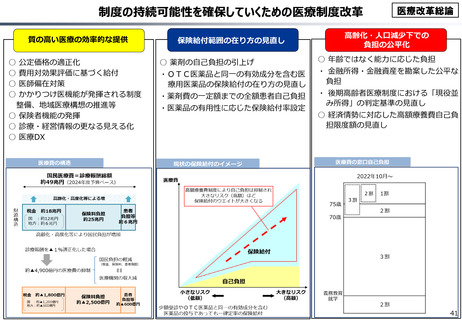
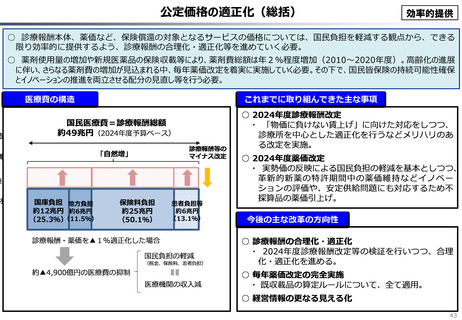
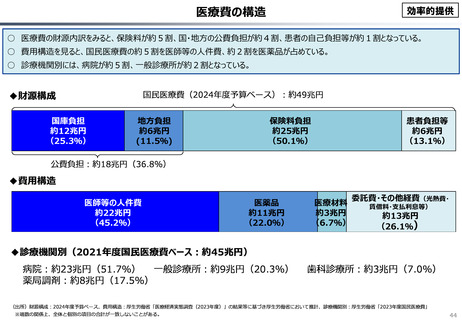
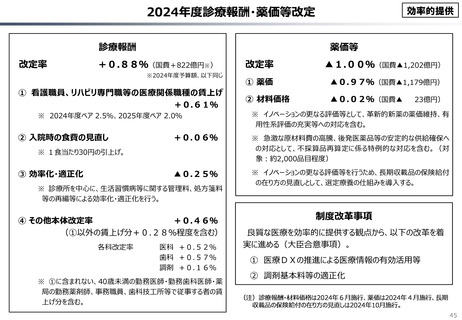
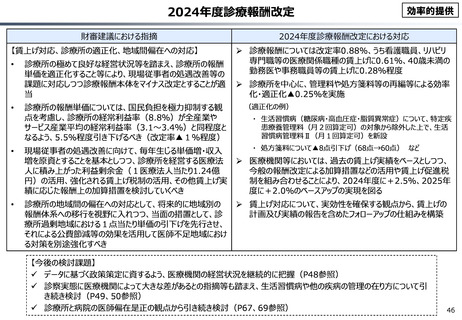
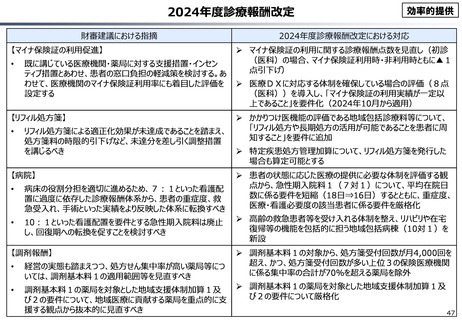
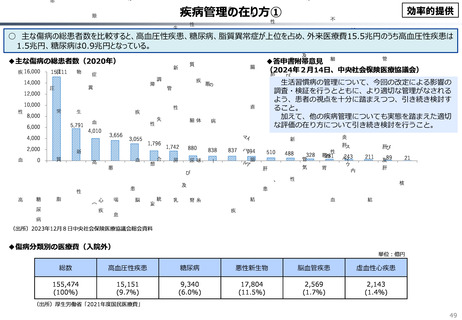
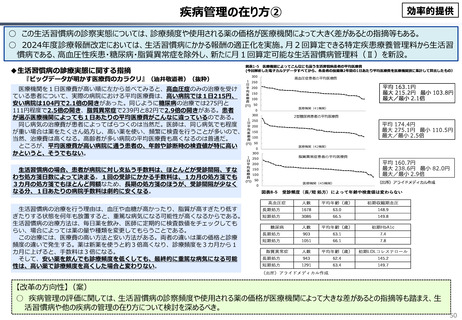
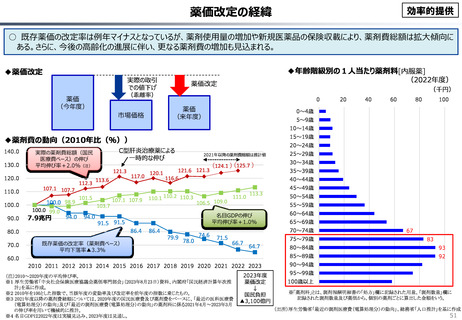
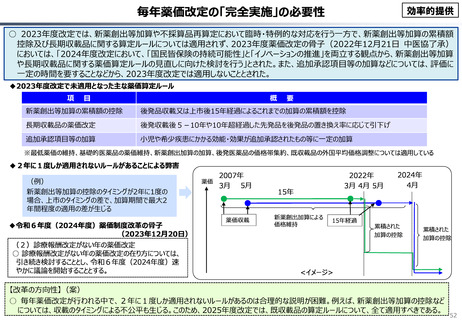
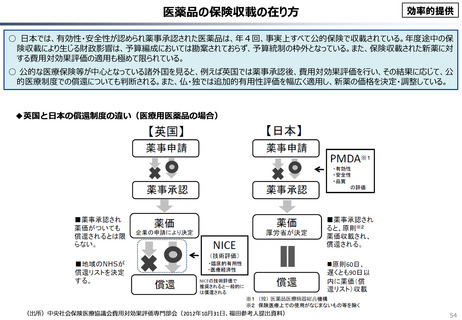
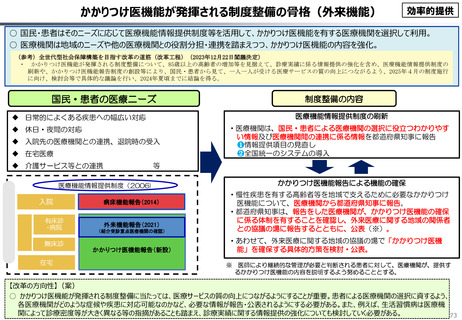
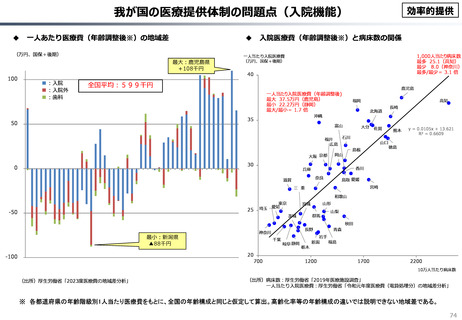
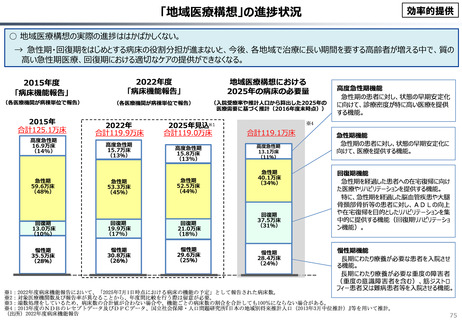
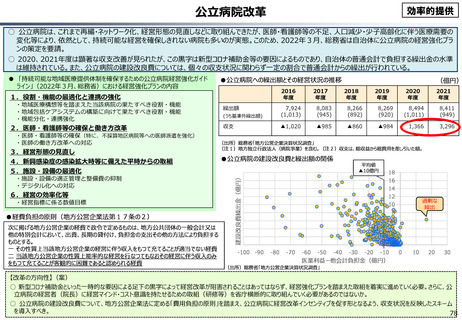
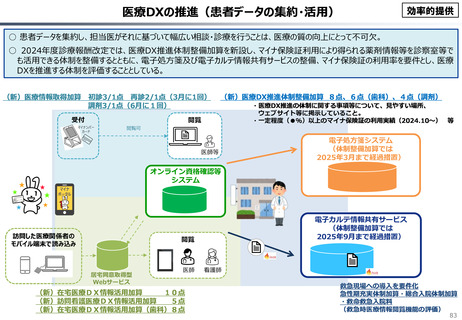
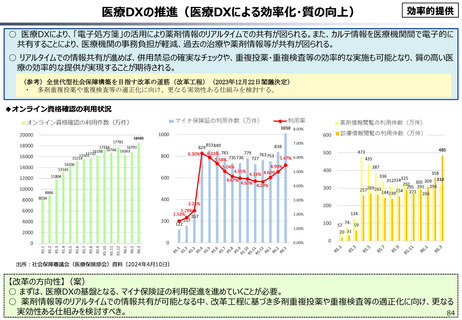
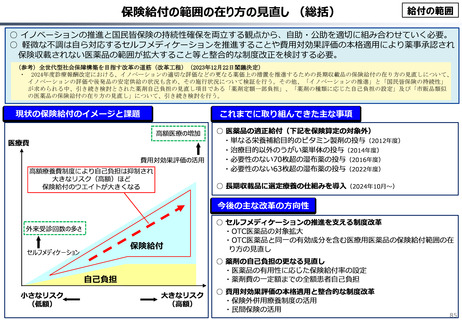
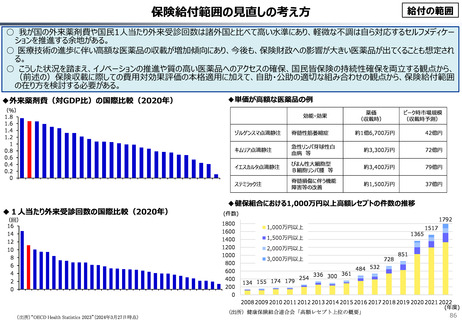
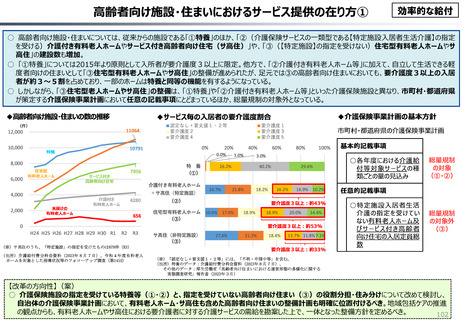
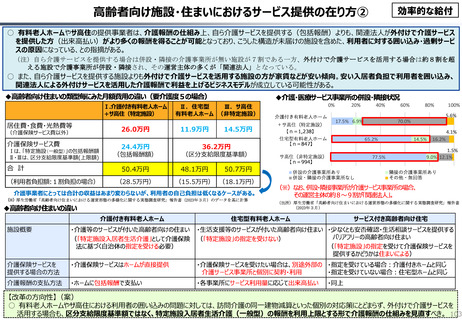
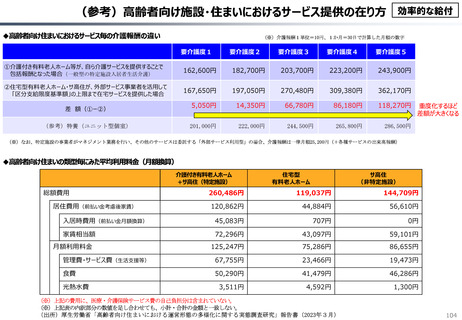
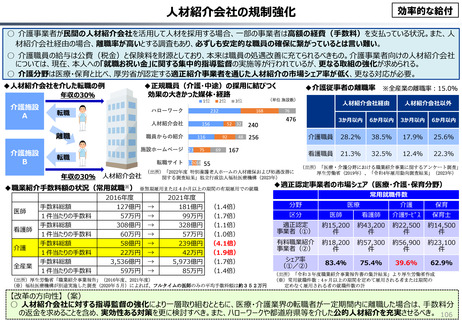
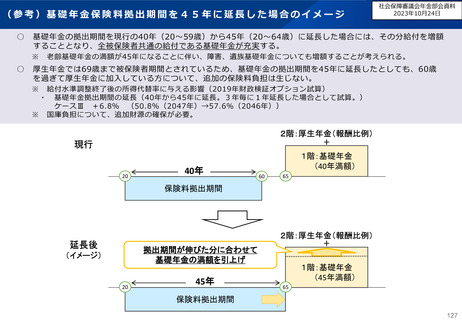
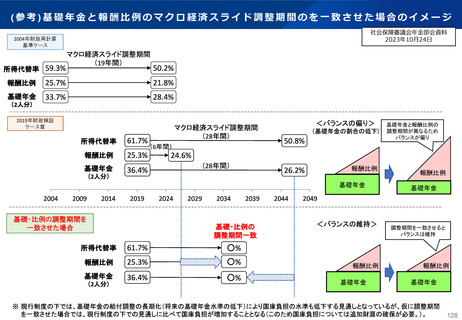
資料 こども・高齢化 (60 ページ)
出典
| 公開元URL | https://www.mof.go.jp/about_mof/councils/fiscal_system_council/sub-of_fiscal_system/proceedings/material/20240416zaiseia.html |
| 出典情報 | 財政制度等審議会 財政制度分科会(4/16)《財務省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
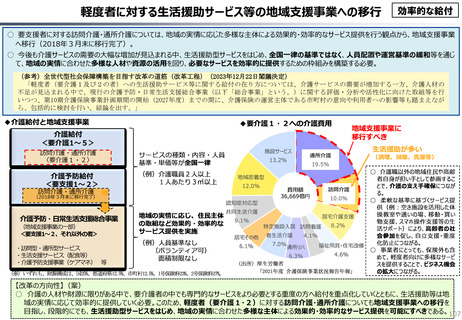
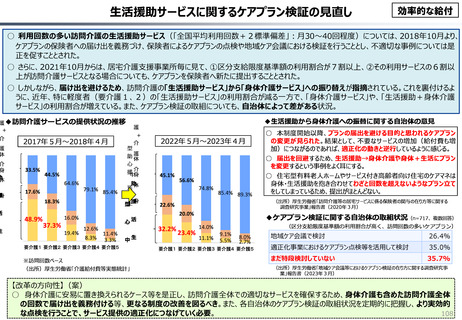
効率的提供
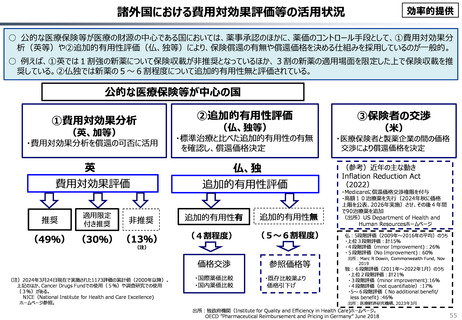
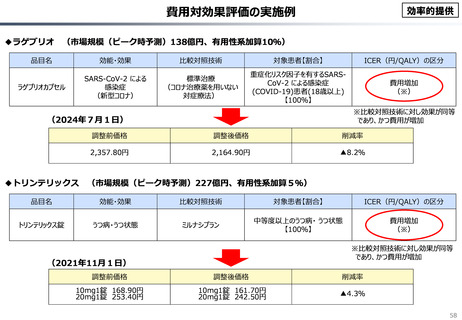
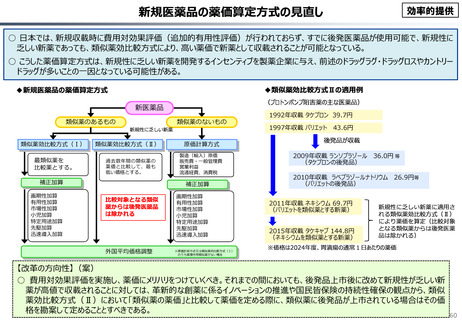
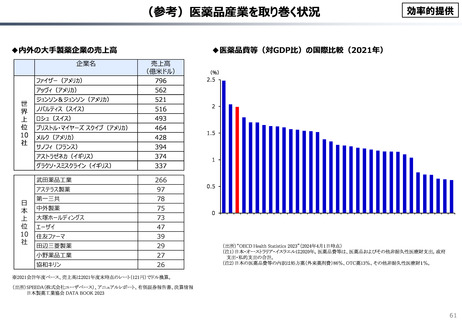
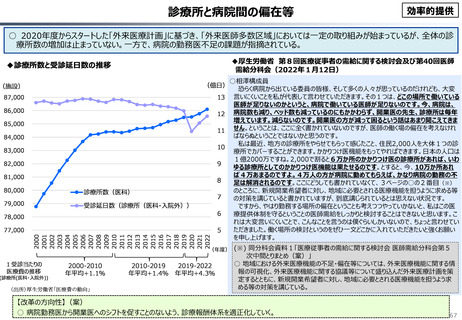
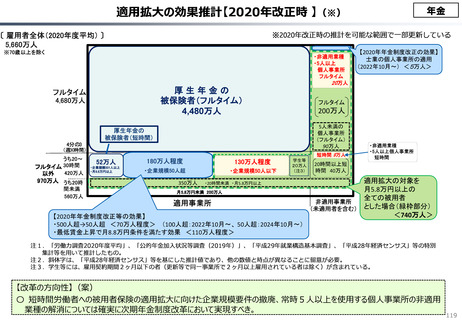
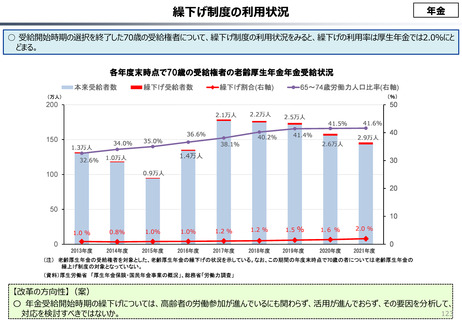
○ 我が国医薬品市場については、承認された新薬の製品数は米国と遜色ない中で、ドラッグラグ・ドラッグロスの課題やカントリードラッグ
(日本でしか流通してない新薬)が多いとの指摘がある。
○ 諸外国と同様、費用対効果評価(追加的有用性評価)を徹底した上で、真に革新的な医薬品と費用対効果が低い医薬品を区
分して評価し、小児用・希少疾患用医薬品を適切に評価することを含め、薬価配分にメリハリをつけることは、我が国の医薬品市場の
魅力を高めるとともに、製薬企業の国際競争力の強化にもつながると考えられる。
◆カントリードラッグの状況
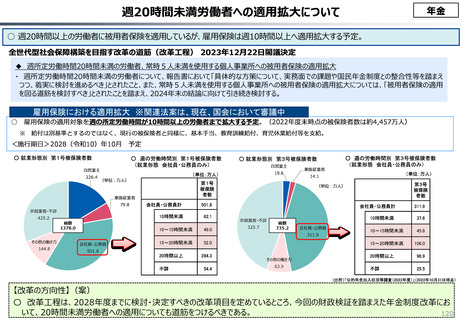
◆新薬の上市状況に関する国際比較
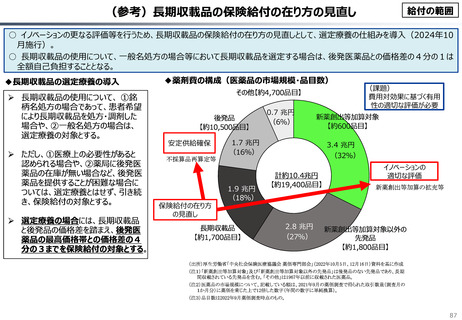
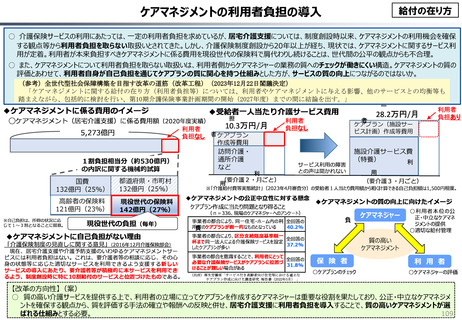
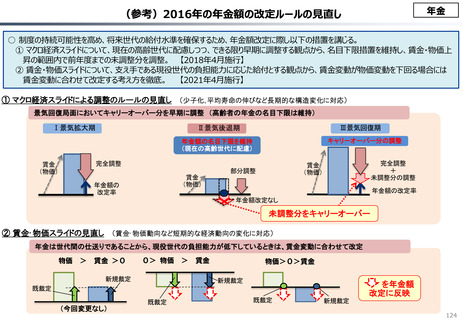
『薬剤給付制度の薬価偏重からの脱却を-給付対象の限定と医師
の処方行動への働きかけを-』(日本総研調査部主任研究員 成
瀬道紀氏)(抜粋)
米国と他の高所得国(26か国)の新薬の上市状況(2018年~
2022年)を調査した米国調査機関のレポートでは、以下の指摘が
なされている。
承認された新薬が原則すべて保険収載されることにより以下
のような影響が生じている。澁口[2021]によれば、2010 ~
2019年に承認されたNME(新有効成分含有医薬品)の数は、
わが国は398品目と世界最大の医薬品市場を誇るアメリカ
(378品目)をも上回る(注23)。世界でよく売れている新薬で
ドラッグ・ラグ、ドラッグ・ロスが生じている現象と一見矛盾
するようであるが、要は海外では通用しない新薬がわが国で多
数承認されているのである。既存薬とさほど効果が変わらない
ような費用対効果が悪い新薬は、海外では給付対象とならない
可能性が高い。こうした新薬でも承認されれば自動的に保険収
載されるわが国の市場は、費用対効果に劣る新薬にとっては魅
力的であり、わが国だけで開発・申請されている新薬も少なく
ないとみられる。
(注23)集計期間が2013 ~ 2019年と日米と異なるが、EUの医薬品
承認審査機関である欧州医薬品庁(EMA)が承認したNMEの品目数は
275品目である。
参考文献:澁口朋之[2021].「日米欧NME承認品目の創出企業の
国籍―2010 ~ 2019年の承認品目を中心に―」政策研ニュース
No.62
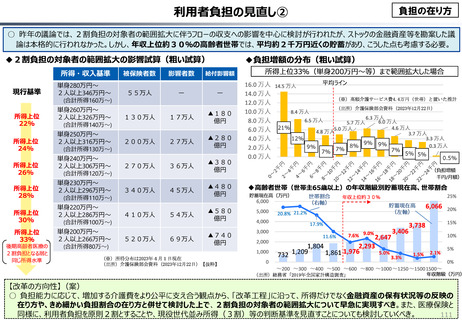
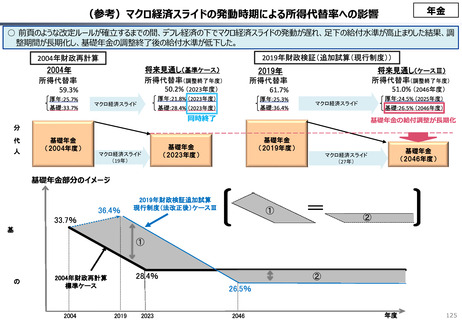
・半数以上の新薬はまず米国で販売される
・米国で販売された新薬は約1年後に他の主要国(*)で販売
されるのが典型的である。*豪、加、仏、独、日、英
・ほとんどの国において、新薬のうち米国で販売されていな
いものが占める割合は小さい。日本はこの割合が39%
(122新薬のうち47新薬)と顕著な例外である
【米国で販売されてない新薬の新薬総数に占める割合(注)】
(注)独、仏、英についてはレポート記載のデータから財務省で計算
・日本 :39%(122新薬のうち47新薬)
・独
:13%(149新薬のうち20新薬)
・仏
:12%(98新薬のうち12新薬)
・英
:11%(122新薬のうち14新薬)
・カナダ:5%(80新薬のうち4新薬)
出所:Mulcahy, Andrew W., Comparing New Prescription Drug Availability and Launch Timing in
the United States and Other OECD Countries, RAND Corporation, RR-A788-4, 2024. As of April 3,
2024: https://www.rand.org/pubs/research_reports/RRA788-4.html
59