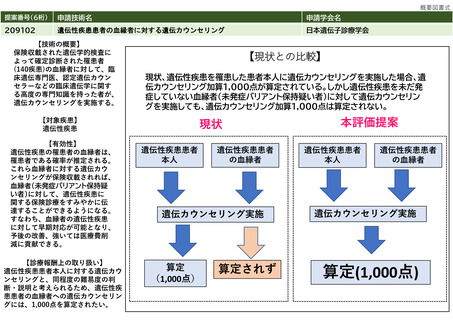
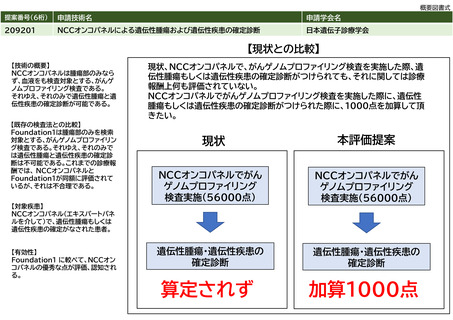
提案書01(0001頁~0202頁)医療技術評価・再評価提案書 (168 ページ)
出典
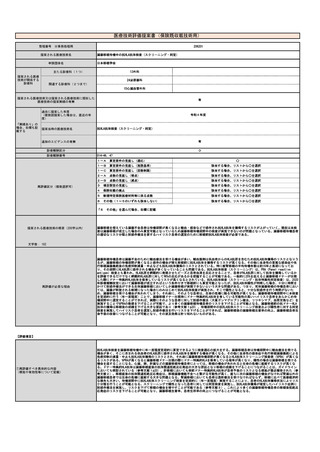
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190899_00011.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬調査専門組織・医療技術評価分科会(令和5年度第1回 11/20)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
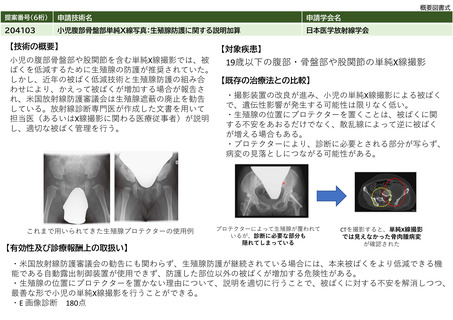
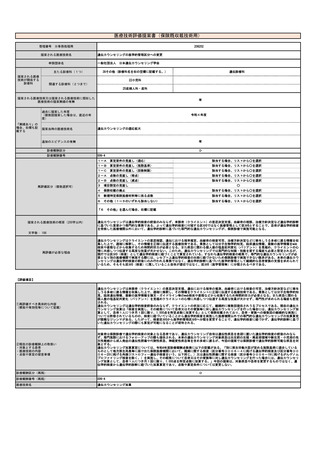
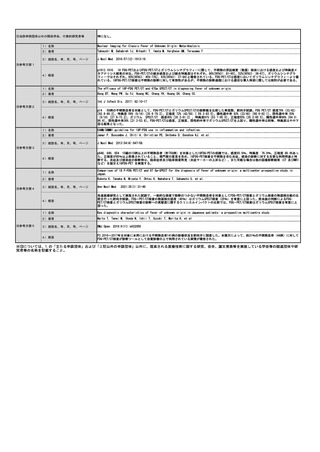
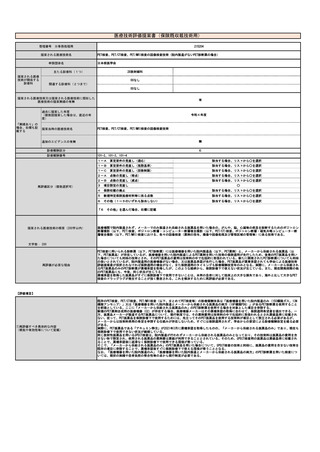
⑤ ④の根拠と
なる研究結果等
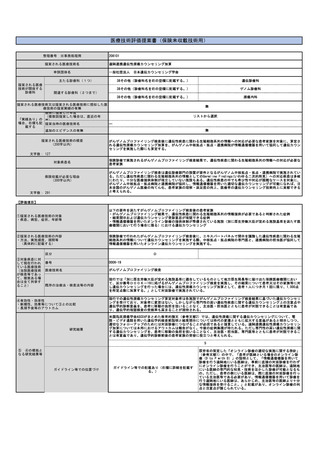
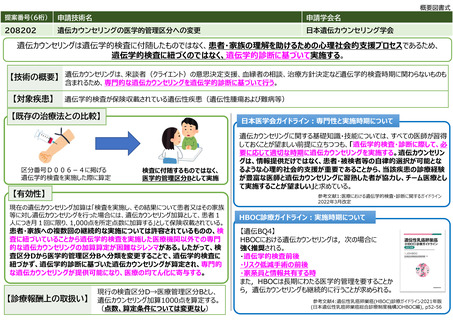
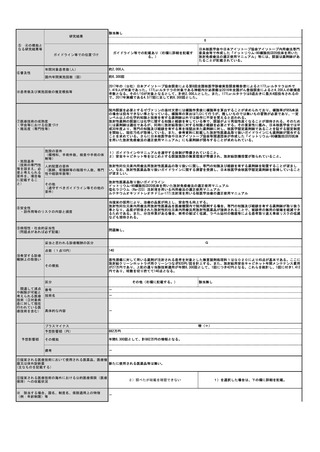
本剤は、国内において「アキュミン静注」として2021年3月に薬事承認されている。
本剤の国内第Ⅲ相試験において、中央画像判定において造影T1強調画像で陰性、本技術で陽性と判定された領域の病理診断
を真のスタンダードとした場合の本技術の視覚的読影結果の陽性的中率は88.0%であった。
また、計画されていた腫瘍摘出範囲について、本技術実施後に47.2%で変更があった(範囲の拡大:30.6%、範囲の縮小:
16.7%)。さらに、本技術で陽性の領域と陰性の領域からそれぞれ採取した腫瘍組織を比較すると、陽性領域の組織で悪性
度が高い傾向が認められた(参考文献3)。
1b
ガイドライン等での位置づけ
ガイドライン等での記載なし(右欄にガイドライン等の
日本核医学会において、臨床使用ガイドラインを作成中である。
改訂の見込み等を記載する。)
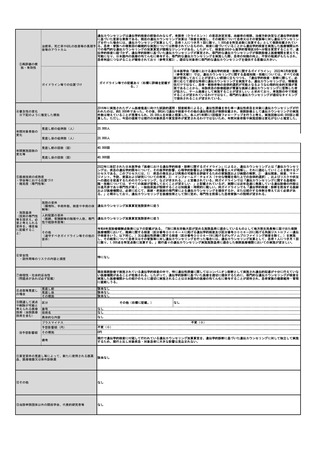
年間対象患者数(人)
2,000人
国内年間実施回数(回)
2,000回
⑥普及性
※患者数及び実施回数の推定根拠等
神経膠腫の年齢調整罹患率は、10万人当たり2.59と報告されている(Neurol Med Chir (Tokyo). 2021;61(8):492-498)。
日本の人口が約12,320万人であることから神経膠腫の年間罹患数は約3,190人と推定される。
本技術の対象は、神経膠腫のうち悪性度の高いもの(悪性神経膠腫)、かつ手術を予定している患者である。2017年度版脳
腫瘍全国集計調査報告(Neurol Med Chir (Tokyo). 2017;57(Suppl 1):9-102.)において神経膠腫のうち悪性神経膠腫の割
合は約66%、神経膠腫の患者のうち手術を受ける割合は約95%と報告されている。
また、本技術は一患者当たり一回の実施となることから、3,190×66%×95%=約2,000件が本技術の年間実施回数となる。
ただし、これら患者がPET検査へアクセスできる必要があり、年間2,000件はあくまで対象となる患者の最大値であり、実際
の実施回数はこれよりも少なくなると想定される。
⑦医療技術の成熟度
・学会等における位置づけ
・難易度(専門性等)
既に保険適用となっているPET検査と同等の難易度で、同等の専門性を要する。
・施設基準
(技術の専門性
等を踏まえ、必
要と考えられる
要件を、項目毎
に記載するこ
と)
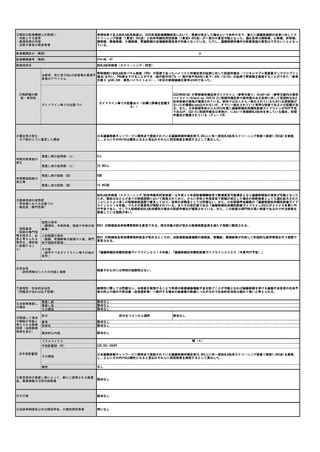
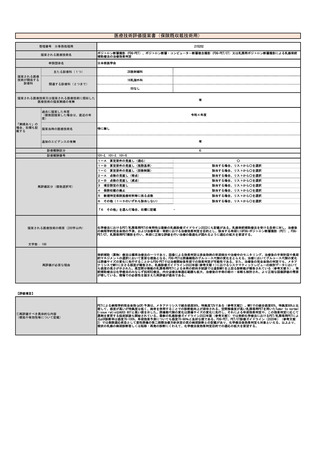
施設の要件
(標榜科、手術件数、検査や手術の体
制等)
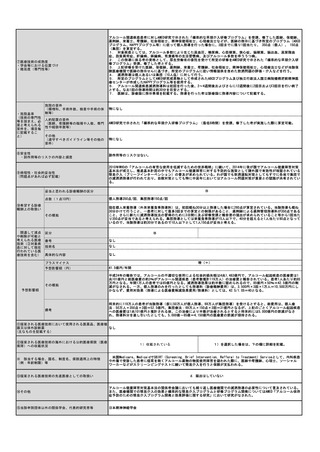
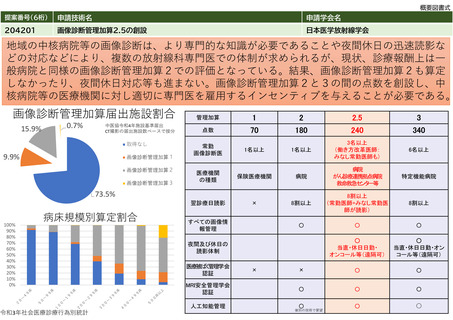
1. 画像診断を担当する常勤の医師(核医学診断について、相当の経験を有し、かつ、核医学診断に係る研修を受けた者に
限る。)が配置されていること。
2. 当該断層撮影を行うにつき十分な機器及び施設を有していること。
3. 当該断層撮影を行うにつき十分な体制が整備されていること。
人的配置の要件
(医師、看護師等の職種や人数、専門
性や経験年数等)
1. 核医学診断の経験を3年以上有し、かつ、日本核医学会が行っているPET核医学検査のための所定の研修を修了した常勤
医師が1名以上いること。
2. 診断撮影機器ごとに、PET製剤の取扱いに関し、専門の知識及び経験を有する専任の診療放射線技師が1名以上いるこ
と。
その他
(遵守すべきガイドライン等その他の
要件)
日本核医学会
臨床使用ガイドライン(作成中)
⑧安全性
・副作用等のリスクの内容と頻度
本剤の国内臨床試験4試験の併合解析において、本剤との因果関係が否定できない有害事象の発現割合は7.8%であった。重
症度が高度の有害事象は1例(血圧上昇)で発現したが、本剤との因果関係は否定された。その他の有害事象の重症度はい
ずれも軽度であった(参考文献2)。
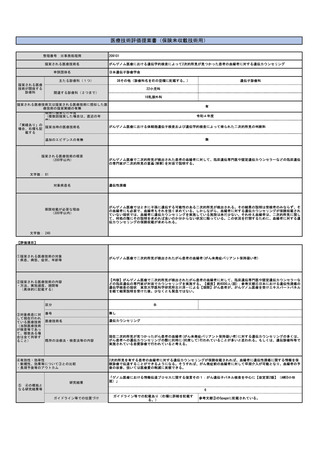
⑨倫理性・社会的妥当性
(問題点があれば必ず記載)
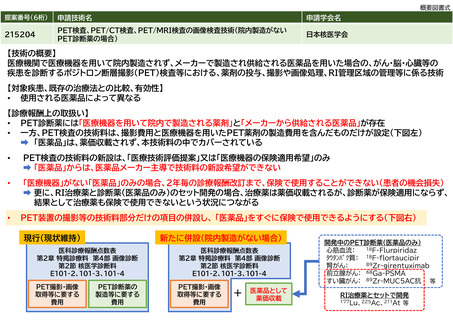
倫理的な問題はない。
既存のPET検査の診療報酬点数は、薬剤の合成費から撮影、読影までの一連を含んだ点数となっている。PET診断薬は医療機
関内で医療機器を用いて合成する場合のほか、本剤のように医薬品メーカーが製造した薬剤を購入する場合があるが、いず
れも同じ点数とされている。そのため、医薬品メーカーが製造した薬剤は薬価収載されず、掲示事項等告示の別表第3に収
載され保険診療下で使用できるようになる。本剤も同様の取扱いになると想定されるが、別表への収載に先立って本技術が
項目として設立される必要がある。
本剤自体は、既に臨床的有効性・安全性が臨床試験において確認され、2021年3月に薬事承認を受けている。しかしなが
ら、上述の診療報酬体系上の問題から、保険診療下で使用できない状況が長く継続している。臨床現場からのニーズも高
く、今後の保険償還が最も期待される薬剤の一つであると報告されており(参考文献4)、また、日本脳神経外科学会より
2022年4月に早期保険適用の要望が厚生労働大臣宛で提出されている。このように、本技術の保険収載の社会的妥当性は非
常に高い。
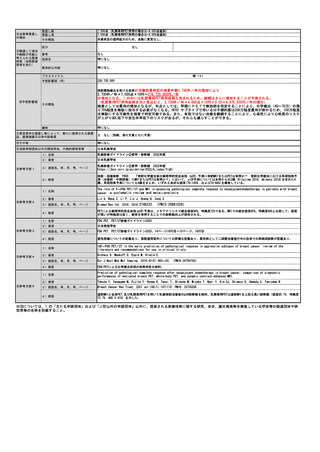
E
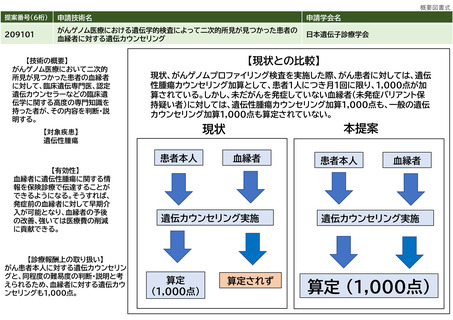
妥当と思われる診療報酬の区分
点数(1点10円)
37,397点(PET装置の場合)、38,380点(PET/CT装置の場合)、38,915点(PET/MRI装置の場合)
本技術については、患者への本剤の投薬やPET装置の運転、撮影、撮影後の画像の読影等に関する点数(PET検査全般に係る
点数)と薬剤費に関する点数を考慮する必要がある。
⑩希望する診療
報酬上の取扱い
その根拠
PET検査全般に係る点数:
PET装置を用いた場合、「E101-2 ポジトロン断層撮影 18FDGを用いた場合:7,500点」となっている。この点数は、18FDGの
合成費用(薬剤費相当)を含んでおり、PET医薬品としての18FDGの販売価格は税込み49,720円(4,972点相当)となってい
る(放射性医薬品の卸売会社である日本アイソトープ協会の価格表より)。従って、合成費用(薬剤費相当)を除いた点数
は、2,528点となる。PET/CT装置の場合、「E101-3 2:8,625点」、PET/MRI装置の場合、「E101-4:9,160点」であり、同様
の計算により、それぞれ、3,653点、4,188点となる。
薬剤費:
本剤は医療機関内では合成されず、医薬品メーカーから購入する必要がある。
当該メーカーに確認したところ、347,266円 であったことから、34,727点となる。
以上より、PET装置:2,528点+34,727点=37,255点、PET/CT装置:3,653点+34,727点=38,380点、PET/MRI装置:4,188点
+34,727点=38,915点となる
関連して減点
や削除が可能と
考えられる医療
技術(③対象疾
患に対して現在
行われている医
療技術を含む)
区分
その他(右欄に記載する。)
番号
特になし
技術名
特になし
具体的な内容
特になし
特になし
増(+)
プラスマイナス
予想影響額(円)
745,100,000円~778,300,000円
その根拠
PET装置、PET/CT装置、PET/MRI装置のうち、いずれの装置を用いて撮影するかによって点数が変わる。
全ての検査が、最も点数の低いPET装置で行われた場合、本技術37,255点、年間検査数2,000件、実施回数は1回のみであり
745,100,000円、最も点数が高いPET/MRI装置で行われた場合、本技術38,915点なので778,300,000円のプラスとなる。
備考
本技術と同じく放射性同位元素で標識されたアミノ酸(11C標識メチオニン)を用いたPET検査をMRI検査に上乗せして腫瘍
摘出術を実施した場合の費用対効果について、改善される生存年(life year:LY)を指標とした増分費用効果比
(Incremental cost-effectiveness ratio: ICER)が報告されており、€1=140円とすると、574,700円/LYとなる(参考文献
5)。本邦におけるICERの閾値は500万円/LYとされているが、閾値に比べ非常に小さく、極めて費用対効果に優れた技術で
ある。
予想影響額
168