よむ、つかう、まなぶ。
資料5 新たに定期接種に位置づけられるワクチンに係る副反応疑い報告基準について (36 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00170.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第110回 2/4)医薬品等安全対策部会安全対策調査会(令和7年度第11回 2/4)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
高用量インフルエンザワクチンの安全性についての知見
第32回厚生科学審議会予防接種・ワクチン分科会
予防接種基本方針部会ワクチン評価に関する小委員会
2025(令和7)年10月22日
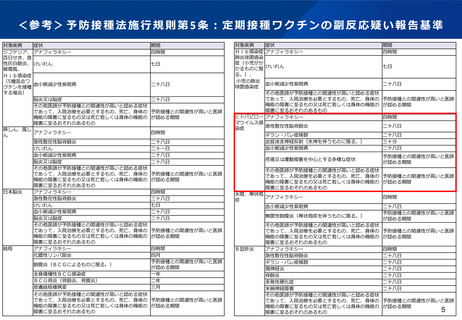
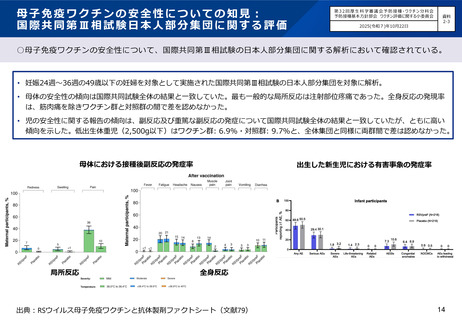
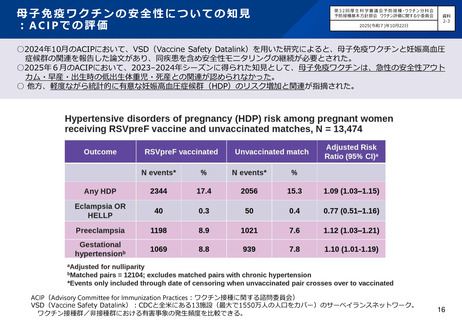
○国内第Ⅲ相臨床試験(QHD00010試験)における、高用量インフルエンザワクチン筋肉注射(n=1,049)と、標準量
インフルエンザワクチン皮下注射(n=1,051)の安全性の比較において、高用量インフルエンザワクチン群が発熱等
の有害事象の頻度が高い傾向にあったが、重篤な有害事象の頻度は同等であった。
• 7日以内の特定反応のうち、注射部位反応の発現割合は、 4価高用量インフルエンザワクチン(HD-IIV4)群
(52.0%)が、 4価標準量インフルエンザワクチン(SD-IIV4)群(49.0%)よりわずかに高かったが、
Grade3の報告はHD-IIV4群(0.9%)と SD-IIV4群(1.3%)で同等であった。7日以内の特定反応のうち、全身
性の反応の発現割合は、 HD-IIV4群(28.5%)がSD-IIV4群(19.4%)より高い傾向にあったが、Grade3の報告
はHD-IIV4群(0.5%)とSD-IIV4群(0.2%)で同等であった。発熱は、 HD-IIV4群で8例(0.8%)、 SD-IIV4群
で1例(<0.1%)あり、39度以上はHD-IIV4群で3例認めた。
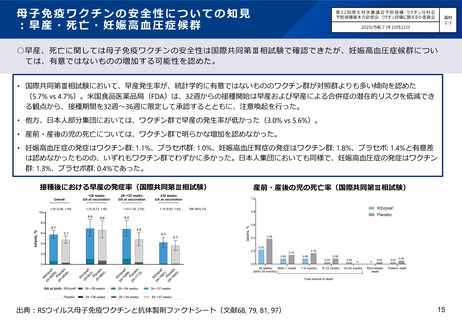
• 重篤な有害事象はHD-IIV4群で2例(0.2%)、 SD-IIV4群で5例(0.5%)認められたが、 HD-IIV4群について
はいずれも因果関係は否定された。
• 治験中止に至った有害事象についてはHD-IIV4群で1例(<0.1%)、 SD-IIV4群で3例(0.3%)認められたが、
いずれも因果関係は否定された。
• 死亡例の報告はなかった。
出典:高齢者に対するインフルエンザワクチンファクトシート(文献45)
36
資料
1-2
第32回厚生科学審議会予防接種・ワクチン分科会
予防接種基本方針部会ワクチン評価に関する小委員会
2025(令和7)年10月22日
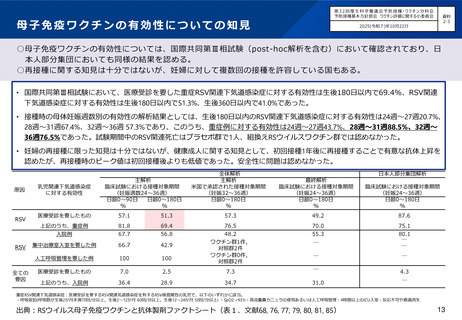
○国内第Ⅲ相臨床試験(QHD00010試験)における、高用量インフルエンザワクチン筋肉注射(n=1,049)と、標準量
インフルエンザワクチン皮下注射(n=1,051)の安全性の比較において、高用量インフルエンザワクチン群が発熱等
の有害事象の頻度が高い傾向にあったが、重篤な有害事象の頻度は同等であった。
• 7日以内の特定反応のうち、注射部位反応の発現割合は、 4価高用量インフルエンザワクチン(HD-IIV4)群
(52.0%)が、 4価標準量インフルエンザワクチン(SD-IIV4)群(49.0%)よりわずかに高かったが、
Grade3の報告はHD-IIV4群(0.9%)と SD-IIV4群(1.3%)で同等であった。7日以内の特定反応のうち、全身
性の反応の発現割合は、 HD-IIV4群(28.5%)がSD-IIV4群(19.4%)より高い傾向にあったが、Grade3の報告
はHD-IIV4群(0.5%)とSD-IIV4群(0.2%)で同等であった。発熱は、 HD-IIV4群で8例(0.8%)、 SD-IIV4群
で1例(<0.1%)あり、39度以上はHD-IIV4群で3例認めた。
• 重篤な有害事象はHD-IIV4群で2例(0.2%)、 SD-IIV4群で5例(0.5%)認められたが、 HD-IIV4群について
はいずれも因果関係は否定された。
• 治験中止に至った有害事象についてはHD-IIV4群で1例(<0.1%)、 SD-IIV4群で3例(0.3%)認められたが、
いずれも因果関係は否定された。
• 死亡例の報告はなかった。
出典:高齢者に対するインフルエンザワクチンファクトシート(文献45)
36
資料
1-2