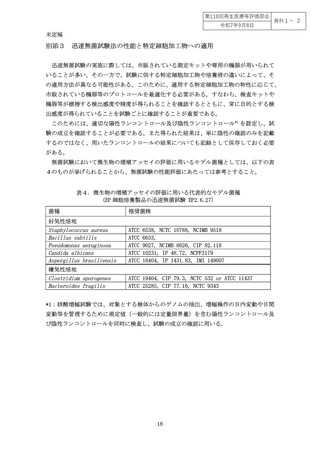
よむ、つかう、まなぶ。
特定細胞加工物の微生物学的安全性指針(案)[1.1MB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_63117.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第110回 9/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
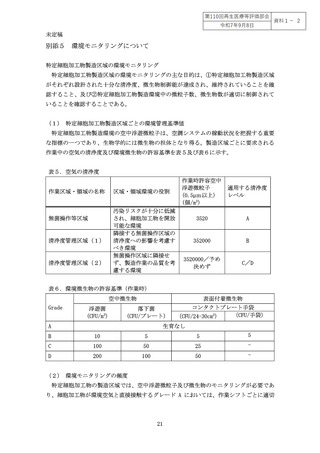
未定稿
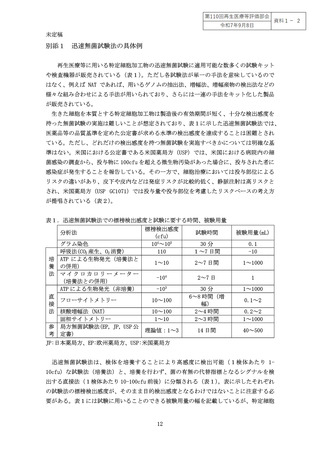
また製法における培養の有無や、培養期間の違い(短期か長期か)、特定細胞加工物
の凍結保存の有無などによって適用できる無菌試験や無菌試験の最適な実施時期が異な
る。
例えば、3-4日の比較的短期の培養工程で、培養工程中に微生物培養法を用いた迅
速無菌試験を実施した場合、再生医療等の提供の可否を判断、又は提供するまでに最終
産物における無菌試験の陰性確認を行うことが不可能な場合が多い。従って、このよう
な短期間しか培養しない場合には、出荷判定又は提供の可否の判断を目的として培養法
以外の迅速無菌試験を実施することが有用であり、培養法を用いた無菌試験を別途実施
する場合には、その結果は工程管理の一環である工程内試験か、中間体試験として位置
付けられる。ただし、試験検体採取以降の工程を閉鎖系の無菌化工程として実施できる
ことが確認でき、無菌化工程以降で菌の増殖が否定できる場合にはこの限りではない。
最終産物を被験物とする場合には試験結果が得られるまでの時間も考慮する必要があり、
検査の検出感度に加え、試験実施のタイミングについても十分に考慮すること。
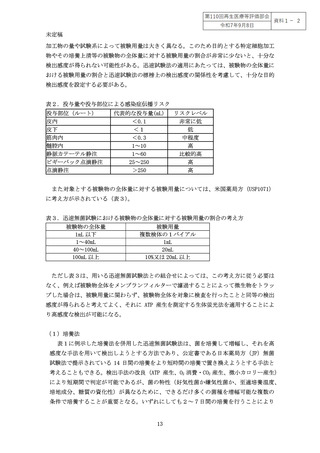
また、特定細胞加工物を外部機関に委託して製造している場合には、委託機関からの
輸送に時間を要する可能性があり、迅速無菌試験法の実施から患者への投与までに時間
が空いてしまう可能性があり、その間に検査時点では検出限界以下であったわずかな汚
染菌の増殖を引き起こす可能性も危惧される。このため、無菌試験の結果を適用できる
有効期間を規定しておくこと。また、このような迅速無菌試験法では検出できなかった
わずかな汚染が顕在化するリスク等を考慮して輸送時の温度管理(施行規則Ⅶ(48)省令
第 99 条第1項第 25 号関係)や不適切な取扱いによる汚染防止や交差汚染の防止対策
(施行規則Ⅶ(43)省令第 99 条第1項第 11 号関係)をあらかじめ検討すること。また、
実際の輸送時における温度等の記録も保管しておくこと。
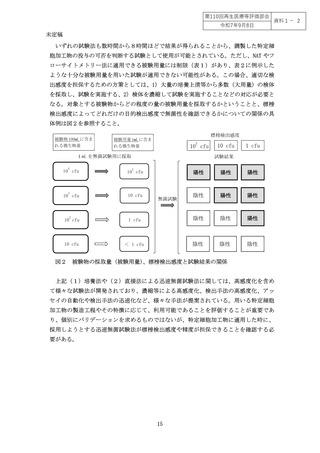
なお、培養・加工工程で適用する無菌試験が増殖性の生きた微生物の有無を確認でき
るものである場合には、特定細胞加工物を用いた再生医療等が提供された後に結果が判
明するものの場合であっても、陽性反応が出た場合の迅速な患者対応が可能となる。そ
のため、迅速無菌試験を実施した場合であっても、提供後を含めた包括的なリスク管理
の一環として培養法による無菌試験を実施することが有用である。
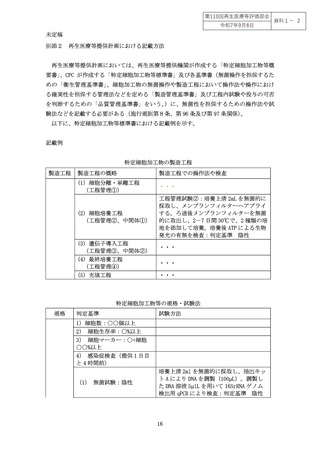
したがって、特定細胞加工物の無菌試験として、最終産物である特定細胞加工物のみ
ならず製造工程中での無菌試験の実施タイミングを含めて、どの試験をどの段階で実施
するかは、目的とする特定細胞加工物の製造方法の特性や、工程内管理として用いるの
か、出荷判定又は人への投与判断に用いるのかという目的によっても異なってくる(別
添1図1)。無菌試験に求める感度の適切性については、投与する特定細胞加工物の量
や投与部位なども考慮して判断する必要がある(別添1)。
7
また製法における培養の有無や、培養期間の違い(短期か長期か)、特定細胞加工物
の凍結保存の有無などによって適用できる無菌試験や無菌試験の最適な実施時期が異な
る。
例えば、3-4日の比較的短期の培養工程で、培養工程中に微生物培養法を用いた迅
速無菌試験を実施した場合、再生医療等の提供の可否を判断、又は提供するまでに最終
産物における無菌試験の陰性確認を行うことが不可能な場合が多い。従って、このよう
な短期間しか培養しない場合には、出荷判定又は提供の可否の判断を目的として培養法
以外の迅速無菌試験を実施することが有用であり、培養法を用いた無菌試験を別途実施
する場合には、その結果は工程管理の一環である工程内試験か、中間体試験として位置
付けられる。ただし、試験検体採取以降の工程を閉鎖系の無菌化工程として実施できる
ことが確認でき、無菌化工程以降で菌の増殖が否定できる場合にはこの限りではない。
最終産物を被験物とする場合には試験結果が得られるまでの時間も考慮する必要があり、
検査の検出感度に加え、試験実施のタイミングについても十分に考慮すること。
また、特定細胞加工物を外部機関に委託して製造している場合には、委託機関からの
輸送に時間を要する可能性があり、迅速無菌試験法の実施から患者への投与までに時間
が空いてしまう可能性があり、その間に検査時点では検出限界以下であったわずかな汚
染菌の増殖を引き起こす可能性も危惧される。このため、無菌試験の結果を適用できる
有効期間を規定しておくこと。また、このような迅速無菌試験法では検出できなかった
わずかな汚染が顕在化するリスク等を考慮して輸送時の温度管理(施行規則Ⅶ(48)省令
第 99 条第1項第 25 号関係)や不適切な取扱いによる汚染防止や交差汚染の防止対策
(施行規則Ⅶ(43)省令第 99 条第1項第 11 号関係)をあらかじめ検討すること。また、
実際の輸送時における温度等の記録も保管しておくこと。
なお、培養・加工工程で適用する無菌試験が増殖性の生きた微生物の有無を確認でき
るものである場合には、特定細胞加工物を用いた再生医療等が提供された後に結果が判
明するものの場合であっても、陽性反応が出た場合の迅速な患者対応が可能となる。そ
のため、迅速無菌試験を実施した場合であっても、提供後を含めた包括的なリスク管理
の一環として培養法による無菌試験を実施することが有用である。
したがって、特定細胞加工物の無菌試験として、最終産物である特定細胞加工物のみ
ならず製造工程中での無菌試験の実施タイミングを含めて、どの試験をどの段階で実施
するかは、目的とする特定細胞加工物の製造方法の特性や、工程内管理として用いるの
か、出荷判定又は人への投与判断に用いるのかという目的によっても異なってくる(別
添1図1)。無菌試験に求める感度の適切性については、投与する特定細胞加工物の量
や投与部位なども考慮して判断する必要がある(別添1)。
7