よむ、つかう、まなぶ。
特定細胞加工物の微生物学的安全性指針(案)[1.1MB] (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_63117.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第110回 9/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
未定稿
別添1
迅速無菌試験法の具体例
再生医療等に用いる特定細胞加工物の迅速無菌試験に適用可能な数多くの試験キット
や検査機器が販売されている(表1)。ただし各試験法が単一の手法を意味しているので
はなく、例えば NAT であれば、用いるゲノムの抽出法、増幅法、増幅産物の検出法などの
様々な組み合わせによる手法が用いられており、さらには一連の手法をキット化した製品
が販売されている。
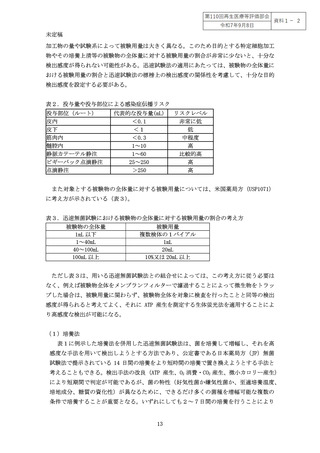
生きた細胞を本質とする特定細胞加工物は製造後の有効期間が短く、十分な検出感度を
持った無菌試験の実施は難しいことが想定されており、表1に示した迅速無菌試験法では、
医薬品等の品質基準を定めた公定書が求める水準の検出感度を達成することは困難とされ
ている。ただし、どれだけの検出感度を持つ無菌試験を実施すべきかについては明確な基
準はない。米国における公定書である米国薬局方(USP)では、米国における病院内の細
菌感染の調査から、投与物に 100cfu を超える微生物汚染があった場合に、投与された者に
感染症が発生することを報告している。その一方で、細胞治療においては投与部位による
リスクの違いがあり、皮下や皮内などは発症リスクが比較的低く、静脈注射は高リスクと
され、米国薬局方(USP GC1071)では投与量や投与部位を考慮したリスクベースの考え方
が提唱されている(表2)
。
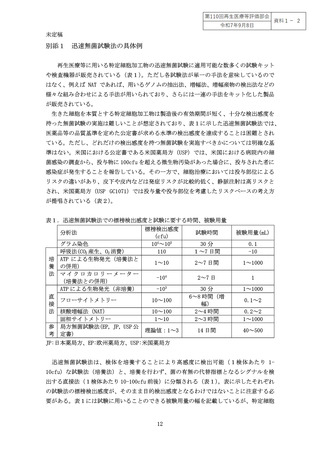
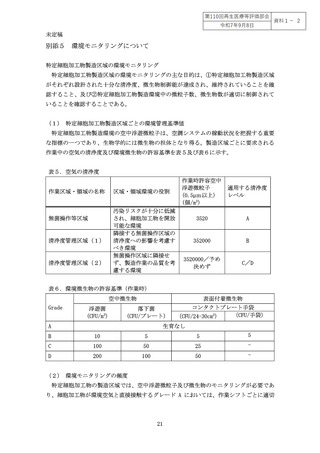
表1.迅速無菌試験法での標榜検出感度と試験に要する時間、被験用量
分析法
培
養
法
直
接
法
参
考
グラム染色
呼吸法(CO2 産生、O2 消費)
ATP による生物発光(培養法と
の併用)
マイクロカロリーメーター
(培養法との併用)
ATP による生物発光(非培養)
標榜検出感度
(cfu)
104~105
110
試験時間
被験用量(mL)
30 分
1~7 日間
0.1
-10
1~10
2~7 日間
1~1000
-104
2~7 日
1
-103
1~1000
40~500
フローサイトメトリー
10~100
核酸増幅法(NAT)
固相サイトメトリー
局方無菌試験法(EP, JP, USP 公
定書)
10~100
1~10
30 分
6~8 時間(増
幅)
2~4 時間
2~3 時間
理論値:1~3
14 日間
0.1~2
0.2~2
1~1000
JP:日本薬局方、EP:欧州薬局方、USP:米国薬局方
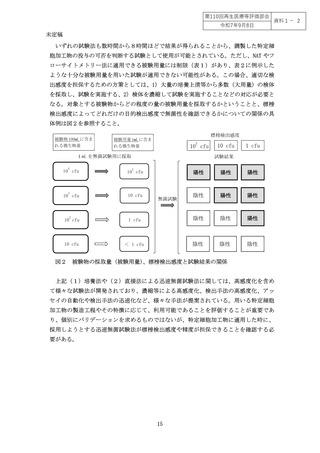
迅速無菌試験法は、検体を培養することにより高感度に検出可能(1検体あたり 110cfu)な試験法(培養法)と、培養を行わず、菌の有無の代替指標となるシグナルを検
出する直接法(1検体あたり 10-100cfu 前後)に分類される(表1)
。表に示したそれぞれ
の試験法の標榜検出感度が、そのまま目的検出感度となるわけではないことに注意する必
要がある。表1には試験に用いることのできる被験用量の幅を記載しているが、特定細胞
12
別添1
迅速無菌試験法の具体例
再生医療等に用いる特定細胞加工物の迅速無菌試験に適用可能な数多くの試験キット
や検査機器が販売されている(表1)。ただし各試験法が単一の手法を意味しているので
はなく、例えば NAT であれば、用いるゲノムの抽出法、増幅法、増幅産物の検出法などの
様々な組み合わせによる手法が用いられており、さらには一連の手法をキット化した製品
が販売されている。
生きた細胞を本質とする特定細胞加工物は製造後の有効期間が短く、十分な検出感度を
持った無菌試験の実施は難しいことが想定されており、表1に示した迅速無菌試験法では、
医薬品等の品質基準を定めた公定書が求める水準の検出感度を達成することは困難とされ
ている。ただし、どれだけの検出感度を持つ無菌試験を実施すべきかについては明確な基
準はない。米国における公定書である米国薬局方(USP)では、米国における病院内の細
菌感染の調査から、投与物に 100cfu を超える微生物汚染があった場合に、投与された者に
感染症が発生することを報告している。その一方で、細胞治療においては投与部位による
リスクの違いがあり、皮下や皮内などは発症リスクが比較的低く、静脈注射は高リスクと
され、米国薬局方(USP GC1071)では投与量や投与部位を考慮したリスクベースの考え方
が提唱されている(表2)
。
表1.迅速無菌試験法での標榜検出感度と試験に要する時間、被験用量
分析法
培
養
法
直
接
法
参
考
グラム染色
呼吸法(CO2 産生、O2 消費)
ATP による生物発光(培養法と
の併用)
マイクロカロリーメーター
(培養法との併用)
ATP による生物発光(非培養)
標榜検出感度
(cfu)
104~105
110
試験時間
被験用量(mL)
30 分
1~7 日間
0.1
-10
1~10
2~7 日間
1~1000
-104
2~7 日
1
-103
1~1000
40~500
フローサイトメトリー
10~100
核酸増幅法(NAT)
固相サイトメトリー
局方無菌試験法(EP, JP, USP 公
定書)
10~100
1~10
30 分
6~8 時間(増
幅)
2~4 時間
2~3 時間
理論値:1~3
14 日間
0.1~2
0.2~2
1~1000
JP:日本薬局方、EP:欧州薬局方、USP:米国薬局方
迅速無菌試験法は、検体を培養することにより高感度に検出可能(1検体あたり 110cfu)な試験法(培養法)と、培養を行わず、菌の有無の代替指標となるシグナルを検
出する直接法(1検体あたり 10-100cfu 前後)に分類される(表1)
。表に示したそれぞれ
の試験法の標榜検出感度が、そのまま目的検出感度となるわけではないことに注意する必
要がある。表1には試験に用いることのできる被験用量の幅を記載しているが、特定細胞
12