よむ、つかう、まなぶ。
特定細胞加工物の微生物学的安全性指針(案)[1.1MB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_63117.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第110回 9/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
未定稿
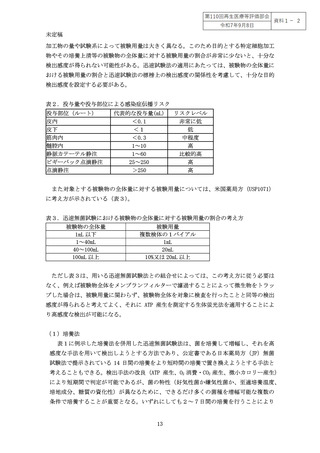
る。特に、細胞加工物の培養が一週間以上に及ぶ場合には、微生物による汚染に気が付
かずに細胞加工物を培養し続けてしまうことによる汚染の拡大を防止するため、工程内
管理として特定細胞加工物の中間体の無菌試験を実施することが必要である。
(2) 出荷判定・投与判断
最終産物である特定細胞加工物の出荷判定や投与の可否の判断のためには、適切な
タイミングでの無菌試験の実施が必要である。無菌試験では、特定細胞加工物の特性
に応じて、試験法を設定する。具体的には、使用する無菌試験法の標榜上の検出感度
(検出限界)等に加え、投与量や投与部位・経路等に応じて、検査に用いる検体のサ
ンプリング方法や量も含めて無菌試験の感度等を事前に確認する。このような確認を
行ったうえで、特定細胞加工物を用いた再生医療等の提供の可否を判断するための試
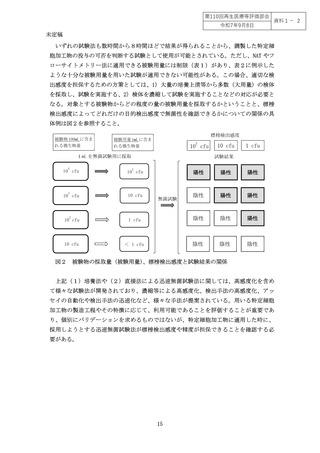
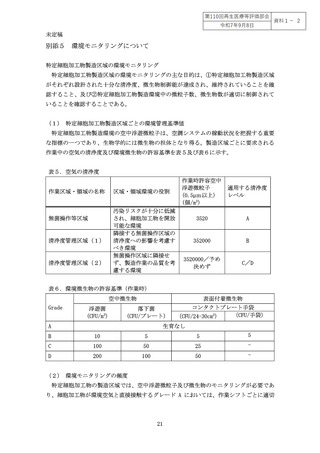
験法として特定細胞加工物の製造時に適用することが必要である(別添1、図2)。
詳細については、「4.無菌試験の設定における検討事項」を参照すること。
(3) 培養工程のない特定細胞加工物
第三種再生医療等として最も多く提供されている多血小板血漿(以下「PRP」とい
う。)等、培養工程がなく、製造工程そのものが非常に短時間である特定細胞加工物
がある。このような特定細胞加工物の場合、万が一、微生物の迷入があった場合でも
製造工程中での増殖リスクは低いと推察されるため、製造工程での菌の増殖リスクが
低いことを考慮した場合には、十分な汚染防止対策を前提に無菌試験の実施を不要と
する選択肢もあり得る。ただし、製造した特定細胞加工物を長期に保存する場合や体
内で免疫細胞による監視が存在しない無菌的部位(関節腔、腹腔、髄腔等)への投与
を行う場合には、無菌試験の実施を考慮すること。また、製造した特定細胞加工物の
一部について定期的に無菌試験を実施し、製造工程の無菌性の検証を行うことが求め
られる。
(4) 長期保存される特定細胞加工物
製造された細胞加工物を極低温の安定な条件に保存し、必要に応じて解凍して患者
に投与する特定細胞加工物では、製造した特定細胞加工物の提供の可否を判断する無
菌試験に要する時間的制約は大きなものではないと考えられる。このような場合、培
養法を用いた感度の高い無菌試験法を実施することが望ましい。
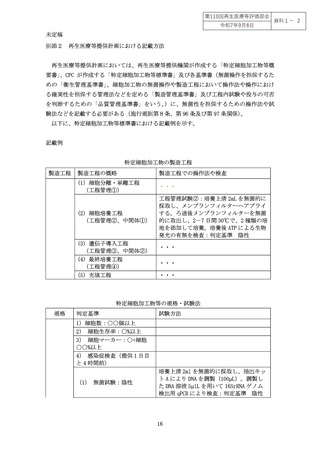
4 無菌試験の設定における検討事項
(1) 投与方法(経路、形態、量を含む。
)とリスク
通常、無菌製剤である医薬品においては、極めて高い検出感度(試験に供した検体あ
たり1コロニー形成単位(以下「cfu」という。))を用いた無菌試験(局方無菌試験)
の実施が求められるが、時間的、量的制約のある特定細胞加工物においては、こうした
5
る。特に、細胞加工物の培養が一週間以上に及ぶ場合には、微生物による汚染に気が付
かずに細胞加工物を培養し続けてしまうことによる汚染の拡大を防止するため、工程内
管理として特定細胞加工物の中間体の無菌試験を実施することが必要である。
(2) 出荷判定・投与判断
最終産物である特定細胞加工物の出荷判定や投与の可否の判断のためには、適切な
タイミングでの無菌試験の実施が必要である。無菌試験では、特定細胞加工物の特性
に応じて、試験法を設定する。具体的には、使用する無菌試験法の標榜上の検出感度
(検出限界)等に加え、投与量や投与部位・経路等に応じて、検査に用いる検体のサ
ンプリング方法や量も含めて無菌試験の感度等を事前に確認する。このような確認を
行ったうえで、特定細胞加工物を用いた再生医療等の提供の可否を判断するための試
験法として特定細胞加工物の製造時に適用することが必要である(別添1、図2)。
詳細については、「4.無菌試験の設定における検討事項」を参照すること。
(3) 培養工程のない特定細胞加工物
第三種再生医療等として最も多く提供されている多血小板血漿(以下「PRP」とい
う。)等、培養工程がなく、製造工程そのものが非常に短時間である特定細胞加工物
がある。このような特定細胞加工物の場合、万が一、微生物の迷入があった場合でも
製造工程中での増殖リスクは低いと推察されるため、製造工程での菌の増殖リスクが
低いことを考慮した場合には、十分な汚染防止対策を前提に無菌試験の実施を不要と
する選択肢もあり得る。ただし、製造した特定細胞加工物を長期に保存する場合や体
内で免疫細胞による監視が存在しない無菌的部位(関節腔、腹腔、髄腔等)への投与
を行う場合には、無菌試験の実施を考慮すること。また、製造した特定細胞加工物の
一部について定期的に無菌試験を実施し、製造工程の無菌性の検証を行うことが求め
られる。
(4) 長期保存される特定細胞加工物
製造された細胞加工物を極低温の安定な条件に保存し、必要に応じて解凍して患者
に投与する特定細胞加工物では、製造した特定細胞加工物の提供の可否を判断する無
菌試験に要する時間的制約は大きなものではないと考えられる。このような場合、培
養法を用いた感度の高い無菌試験法を実施することが望ましい。
4 無菌試験の設定における検討事項
(1) 投与方法(経路、形態、量を含む。
)とリスク
通常、無菌製剤である医薬品においては、極めて高い検出感度(試験に供した検体あ
たり1コロニー形成単位(以下「cfu」という。))を用いた無菌試験(局方無菌試験)
の実施が求められるが、時間的、量的制約のある特定細胞加工物においては、こうした
5