よむ、つかう、まなぶ。
特定細胞加工物の微生物学的安全性指針(案)[1.1MB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_63117.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第110回 9/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
未定稿
特定細胞加工物の微生物学的安全性に関する指針(案)
令和7年〇月〇日 第 1 版
目次
1
2
はじめに....................................................................... 2
特定細胞加工物の微生物学的安全性の考え方について ............................... 2
(1) 従事者の無菌操作に関する知識及び手技の習熟............................... 3
(2) 製造工程管理 ............................................................ 3
(3) 無菌試験等の確認試験 .................................................... 4
3 微生物学的安全性の確保のための無菌試験の役割 ................................... 4
(1) 工程内管理 .............................................................. 4
(2) 出荷判定・投与判断 ...................................................... 5
(3) 培養工程のない特定細胞加工物 ............................................ 5
(4) 長期保存される特定細胞加工物 ............................................ 5
4 無菌試験の設定における検討事項 ................................................. 5
(1) 投与方法(経路、形態、量を含む。
)とリスク................................ 5
(2) 検出感度の考え方 ........................................................ 6
(3) 無菌試験実施のタイミングや検体の選択に関する考え方 ....................... 6
5 無菌試験の選択 ................................................................. 8
(1) 迅速無菌試験法の方法 .................................................... 8
(2) 無菌試験の検出感度の設定 ................................................ 8
(3) 迅速無菌試験の妥当性の確認方法 .......................................... 9
(4) 無菌操作と記録 .......................................................... 9
6 特定細胞加工物等製造施設における環境モニタリングと清掃 ........................ 10
7 投与後の監視 .................................................................. 10
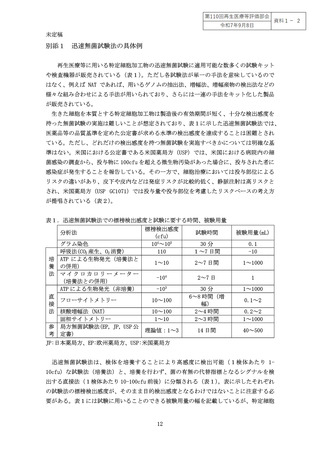
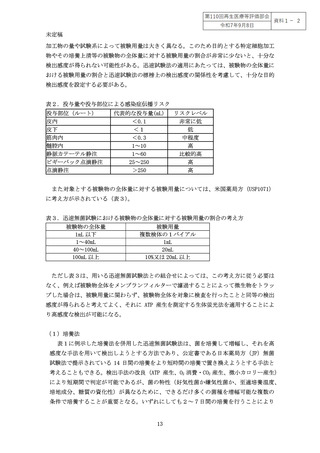
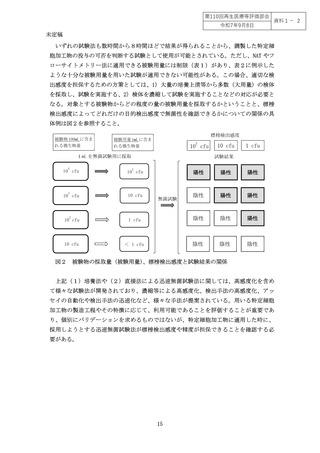
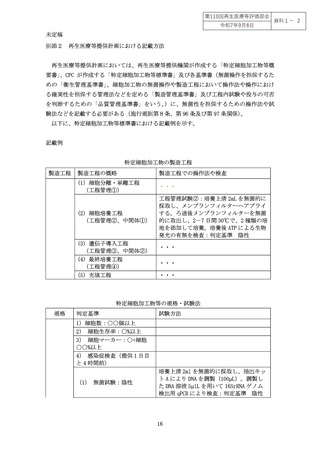
別添1 迅速無菌試験法の具体例 .................................................... 12
別添3 迅速無菌試験法の性能と特定細胞加工物への適用 .............................. 18
別添4 無菌操作工程における無菌性を担保するために留意すべき事項 .................. 19
(1) 細胞採取における留意点 ................................................. 19
(2) 細胞の移送における留意点 ............................................... 19
(3) CPC における留意点 ...................................................... 19
(4) 無菌操作における留意点 ................................................. 19
(5) 培養 CO2 インキュベーターの取扱い ........................................ 19
(6) 無菌操作処理後の資機材等の取扱いの留意点................................ 20
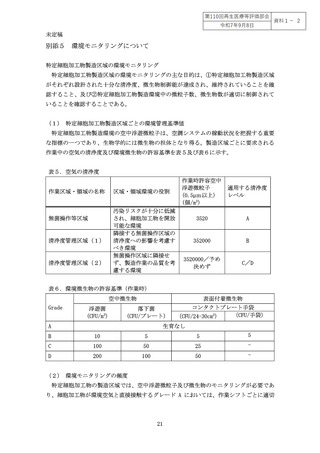
別添5 環境モニタリングについて .................................................. 21
(1) 特定細胞加工物製造区域ごとの環境管理基準値.............................. 21
(2) 環境モニタリングの頻度 ................................................. 21
(3) 微粒子測定 ............................................................. 22
(4) 微生物測定 ............................................................. 22
別添6 特定細胞加工物等製造施設の清掃・消毒について .............................. 24
(1) CPC の清掃・消毒について ................................................ 24
(2) CPC の清掃・消毒頻度について ............................................ 24
(3) CPC の清掃・消毒手順について ............................................ 24
(4) 製造に用いる機器の清掃・消毒手順について................................ 25
(5) 消毒剤について ......................................................... 25
特定細胞加工物の適切な無菌試験の実施に関する検討会議 .............................. 27
構成員 ............................................................................ 27
〔本文書で用いる略称〕
法:再生医療等の安全性の確保等に関する法律(平成 25 年法律第 85 号)
施行規則:再生医療等の安全性の確保等に関する法律施行規則(平成 26 年厚生労働省令第 110 号)
施行通知:「「再生医療等の安全性の確保等に関する法律」、「再生医療等の安全性の確保等に関する法律施
行令」
、
「再生医療等の安全性の確保等に関する法律施行規則」等の取扱いについて」(令和7年5月 15 日
付け医政研発 0515 第 18 号厚生労働省医政局研究開発政策課長通知)
1
特定細胞加工物の微生物学的安全性に関する指針(案)
令和7年〇月〇日 第 1 版
目次
1
2
はじめに....................................................................... 2
特定細胞加工物の微生物学的安全性の考え方について ............................... 2
(1) 従事者の無菌操作に関する知識及び手技の習熟............................... 3
(2) 製造工程管理 ............................................................ 3
(3) 無菌試験等の確認試験 .................................................... 4
3 微生物学的安全性の確保のための無菌試験の役割 ................................... 4
(1) 工程内管理 .............................................................. 4
(2) 出荷判定・投与判断 ...................................................... 5
(3) 培養工程のない特定細胞加工物 ............................................ 5
(4) 長期保存される特定細胞加工物 ............................................ 5
4 無菌試験の設定における検討事項 ................................................. 5
(1) 投与方法(経路、形態、量を含む。
)とリスク................................ 5
(2) 検出感度の考え方 ........................................................ 6
(3) 無菌試験実施のタイミングや検体の選択に関する考え方 ....................... 6
5 無菌試験の選択 ................................................................. 8
(1) 迅速無菌試験法の方法 .................................................... 8
(2) 無菌試験の検出感度の設定 ................................................ 8
(3) 迅速無菌試験の妥当性の確認方法 .......................................... 9
(4) 無菌操作と記録 .......................................................... 9
6 特定細胞加工物等製造施設における環境モニタリングと清掃 ........................ 10
7 投与後の監視 .................................................................. 10
別添1 迅速無菌試験法の具体例 .................................................... 12
別添3 迅速無菌試験法の性能と特定細胞加工物への適用 .............................. 18
別添4 無菌操作工程における無菌性を担保するために留意すべき事項 .................. 19
(1) 細胞採取における留意点 ................................................. 19
(2) 細胞の移送における留意点 ............................................... 19
(3) CPC における留意点 ...................................................... 19
(4) 無菌操作における留意点 ................................................. 19
(5) 培養 CO2 インキュベーターの取扱い ........................................ 19
(6) 無菌操作処理後の資機材等の取扱いの留意点................................ 20
別添5 環境モニタリングについて .................................................. 21
(1) 特定細胞加工物製造区域ごとの環境管理基準値.............................. 21
(2) 環境モニタリングの頻度 ................................................. 21
(3) 微粒子測定 ............................................................. 22
(4) 微生物測定 ............................................................. 22
別添6 特定細胞加工物等製造施設の清掃・消毒について .............................. 24
(1) CPC の清掃・消毒について ................................................ 24
(2) CPC の清掃・消毒頻度について ............................................ 24
(3) CPC の清掃・消毒手順について ............................................ 24
(4) 製造に用いる機器の清掃・消毒手順について................................ 25
(5) 消毒剤について ......................................................... 25
特定細胞加工物の適切な無菌試験の実施に関する検討会議 .............................. 27
構成員 ............................................................................ 27
〔本文書で用いる略称〕
法:再生医療等の安全性の確保等に関する法律(平成 25 年法律第 85 号)
施行規則:再生医療等の安全性の確保等に関する法律施行規則(平成 26 年厚生労働省令第 110 号)
施行通知:「「再生医療等の安全性の確保等に関する法律」、「再生医療等の安全性の確保等に関する法律施
行令」
、
「再生医療等の安全性の確保等に関する法律施行規則」等の取扱いについて」(令和7年5月 15 日
付け医政研発 0515 第 18 号厚生労働省医政局研究開発政策課長通知)
1