よむ、つかう、まなぶ。
令和4年度医療機器・再生医療等製品の自主回収一覧 (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00013.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和5年度第1回 7/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
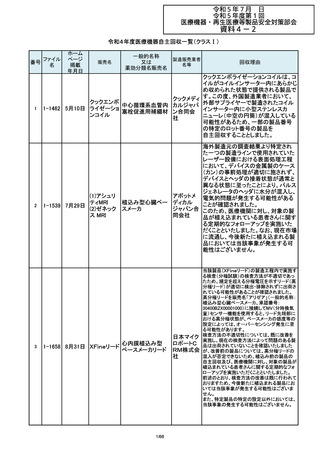
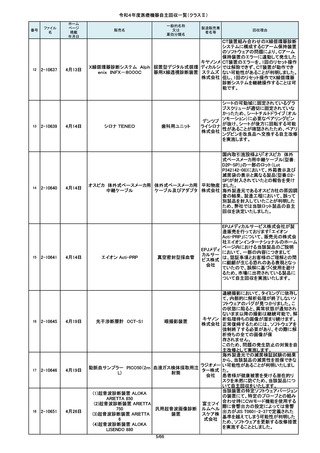
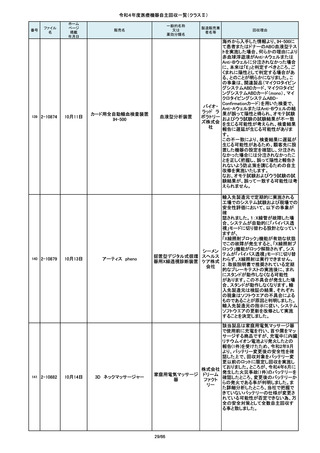
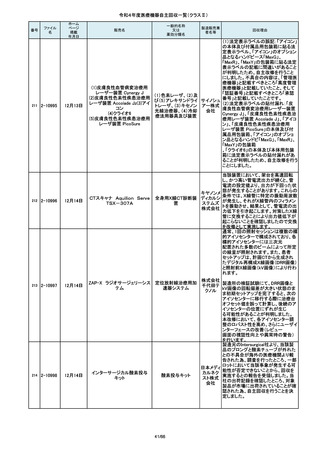
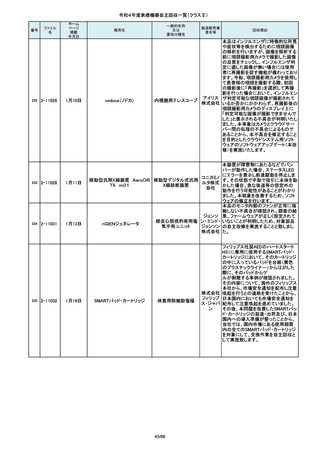
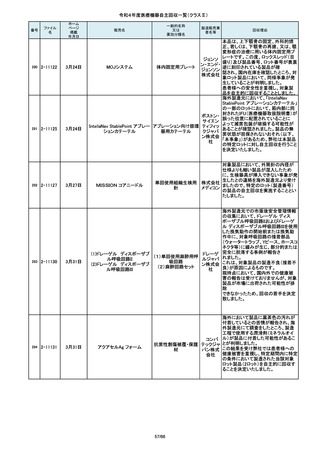
令和4年度医療機器自主回収一覧(クラスⅡ)
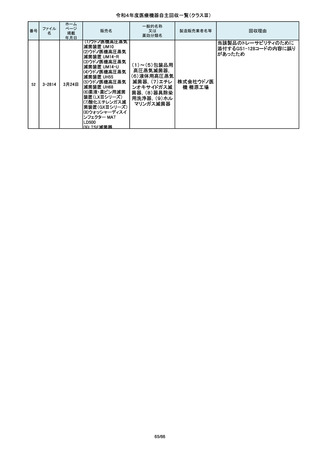
番号
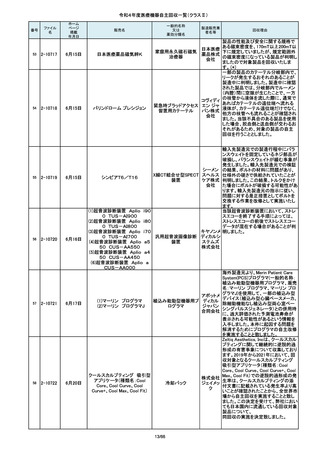
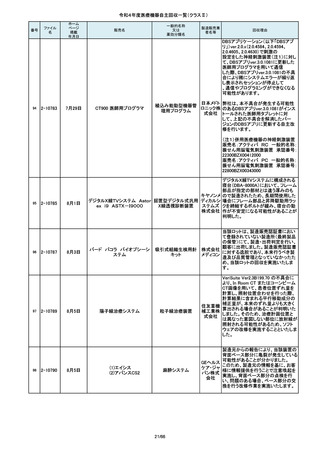
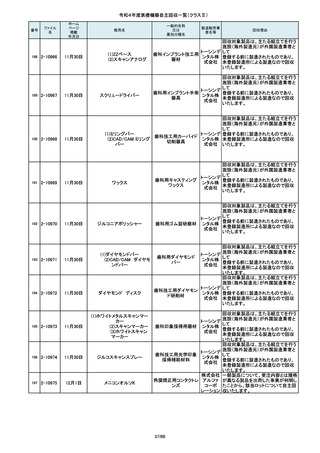
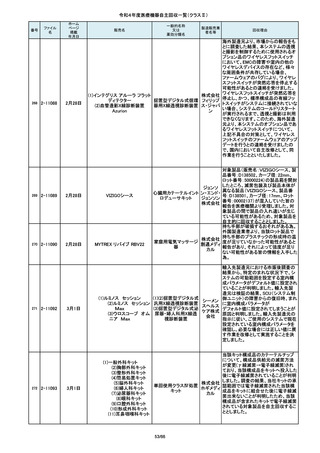
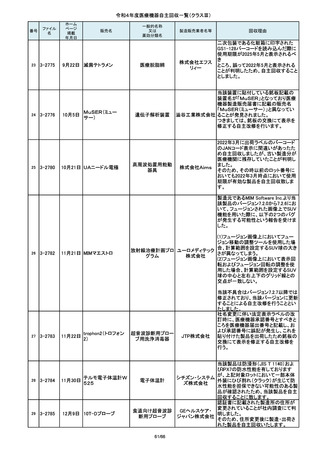
84
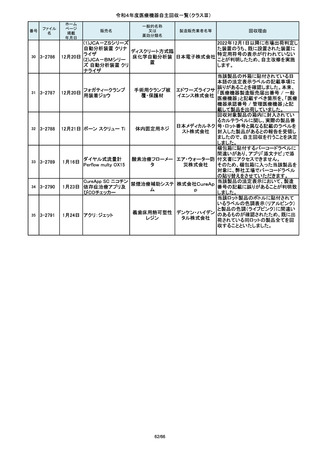
85
86
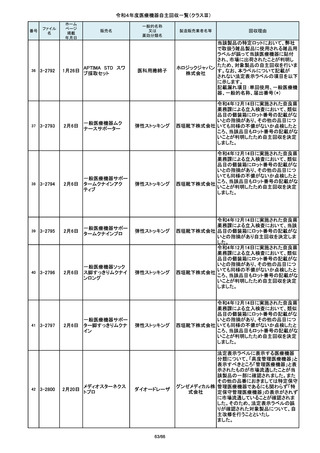
87
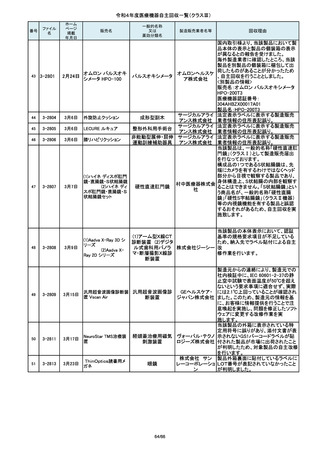
88
ファイル
名
2-10761
2-10763
2-10765
2-10766
2-10769
ホーム
ページ
掲載
年月日
7月20日
7月20日
7月20日
7月20日
7月21日
一般的名称
又は
薬効分類名
販売名
Carestation 750 シリーズ
麻酔システム
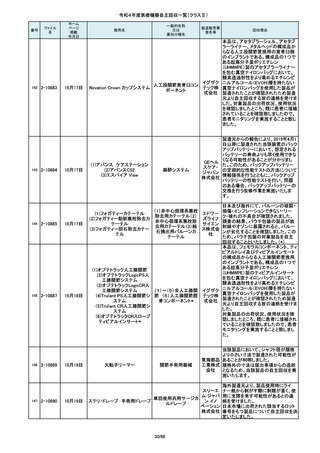
(1)血管撮影システム Trinias
(1),(2)据置型デジタル
(2)血管撮影システム
式循環器用X線透視診
BRANSIST safire
断装置,(3)X線管支持床
(3)循環器用Cアーム型保持
支持台
装置 MH-300
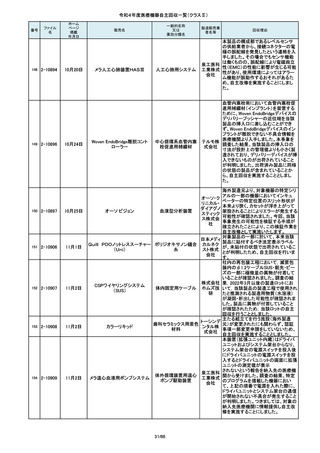
ブレスオーコレクト
超音波内視鏡下穿刺ニードル
シリコーンフォーリーカテーテル
製造販売業
者名等
回収理由
製造元からの連絡により、当該装置の
補助コモンガスアウトレットまたは補助
O2+AIRポートを使用する場合、ガスミ
GEヘルス キサーの不良が発生するおそれがあ
ケア・ジャ ることが分かりました。このため、製造
パン株式 元の情報を基に、お客様に情報提供を
会社 行うことで注意喚起を実施し、問題を
修正したソフトウェア及び圧力リリーフ
バルブに変更する改修作業を実施しま
す。
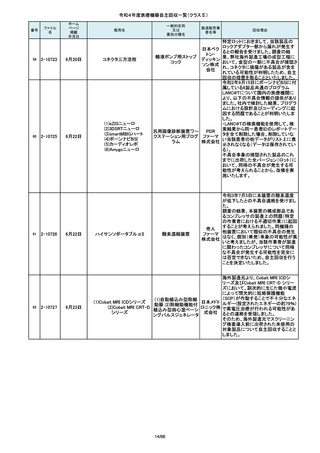
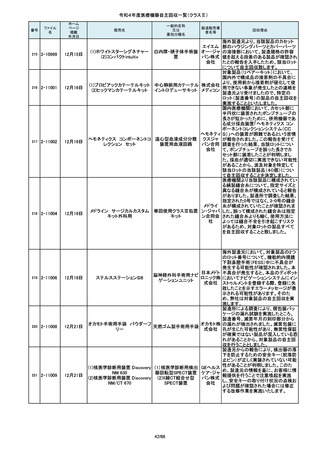
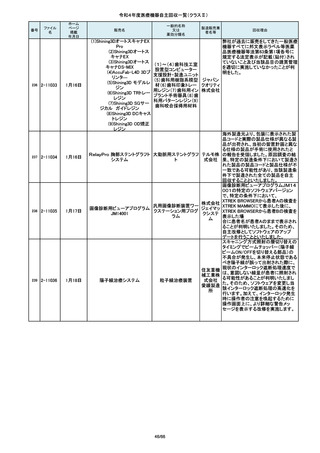
操作者により当該機器のCアームと検診台の天板を
所定の位置へ移動させていた時、移動のためのス
イッチから手を放したが、Cアームの移動は停止した
が検診台の上昇が停止しないという事象が発生しまし
た。
調査の結果、検診台の機械的動作を制御する基板
(以下”当該基板“とします。当該基板はCアームに搭
載)のソフトウェアに不具合があり、以下に示す、検診
台KS-70を組み込んだバイプレーン装置において、ご
くまれに当該事象が発生する可能性があることが判
明しました。そのため、自主改修を実施いたします。
(1)改修対象範囲設定について
1)血管撮影システム Trinias(以下Trinias)
Triniasは平成24年4月4日認証取得以降、継続して製
造販売しており、平成29年8月の一変申請時に当該基
板を変更しました。今回の不具合は変更後の当該基
板で発生することが分かっています。そのため、平成
30年4月以降に製造したバイプレーン装置に変更後の
株式会社 当該基板が搭載されていることから、上記製造番号の
製品を改修の対象と
島津製作 しています。また、それ以前に製造された装置におい
ても、当該基板に変更した装置は改修の対象となって
所
います。(*)
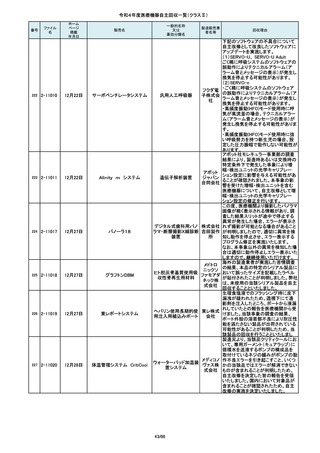
2)血管撮影システム BRANSIST safire(以下
BRANSIST safire)BRANSIST safireは平成18年8月8
日認証取得以降、継続して製造販売しています。新し
い機能などを提供することを目的に、納入している装
置の一部を交換する場合があり、その際、一部の装
置で不具合の原因となった当該基板に変更しておりま
す。製造時期が平成19年3月~平成24年7月の装置
において、平成30年4月以降に当該基板に変更したた
め改修の対象となっています。
3)循環器用Cアーム型保持装置 MH-300(以下MH300)MH-300はTriniasやBRANSIST safireにも構成さ
れるCアーム型保持装置ですが、個別に製造販売届
をしています。新しい機能などを提供することを目的
に、納入している装置の一部を交換する場合があり、
その際、一部の装置で不具合の原因となった当該基
板に変更しております。製造時期が平成20年10月~
平成24年9月の装置において、平成30年4月以降に当
該基板に変更したため改修の対象
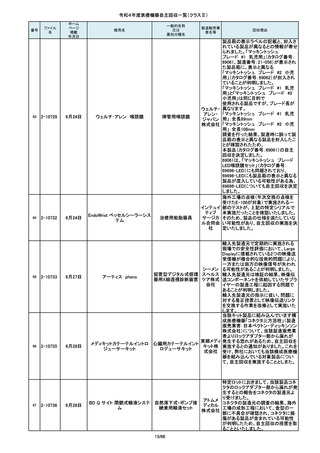
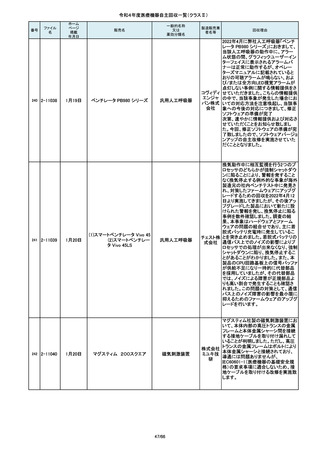
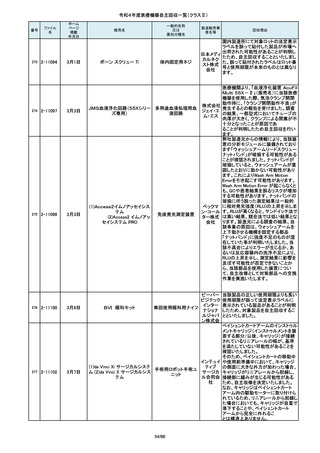
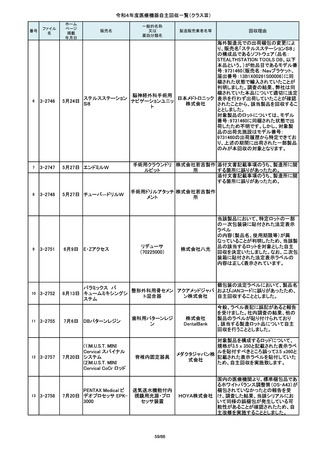
この度、製品パッケージの2種類の表
示規格(FT_41.5/TP_-1.50/DIA_10.6、
FT_42.0/TP_-2.00/DIA_10.6)の間
で一部製品を誤って梱包・出荷された
角膜矯正用コンタクトレ 株式会社 事実が判明いたしました。製造過程に
ンズ
シード おいて製品の取り違えが生じた可能
性が高いと判断し、出荷済みの該当
ロットについて自主回収を決定いたし
ました。
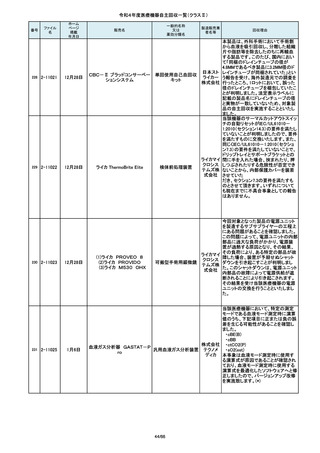
単回使用吸引用針
短期的使用泌尿器用
フォーリーカテーテル
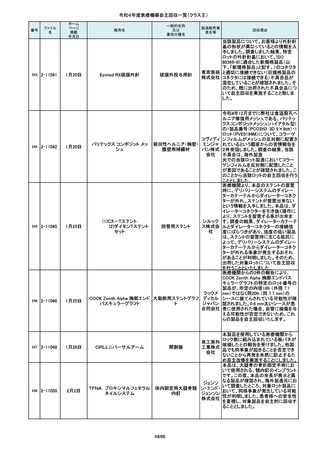
19/66
国内の医療機関より、本品と併用した
超音波内視鏡において、使用後の洗
浄点検時に漏水が検知された事例が
複数報告されました。現在製造元にて
原因を調査中ではございますが、これ
センチュ
まで国内でのみ同事象の報告を受け
リーメディ
ていることから国内市場に出荷されて
カル株式
いるすべて製品について、同様の不具
会社
合の発生の可能性を否定出来ないた
め、自主回収を実施することとしまし
た。
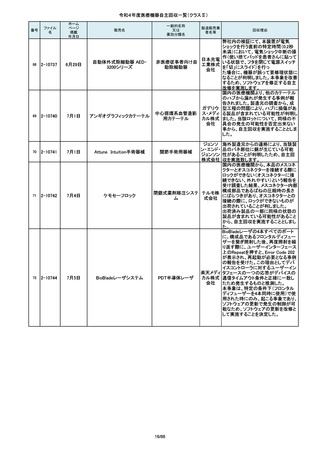
市場より二次包装の箱ラベル表記に
誤記載があるとの連絡を受けました。
記録を調査した結果、対象ロット品に
富士シス のみ二次包装の箱ラベルの滅菌年
テムズ株 月、および使用期限に誤記載の有るこ
式会社 とが判明致しまので、自主回収を行う
事と致しました。
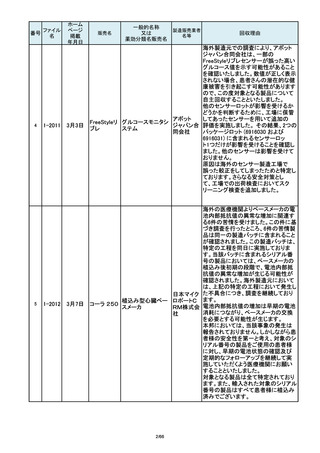
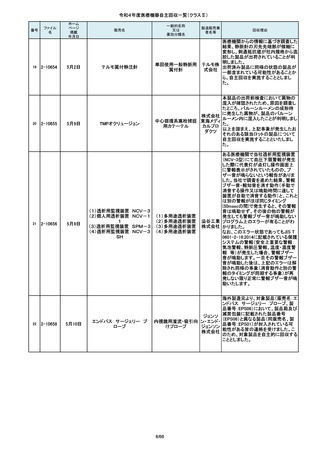
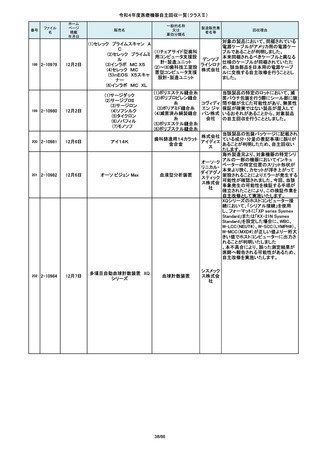
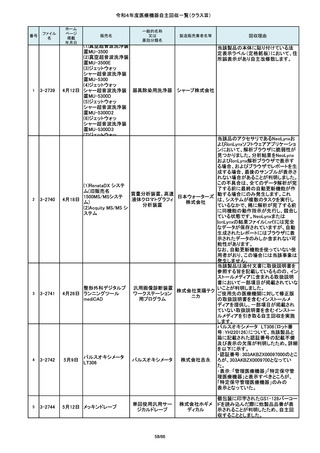
番号
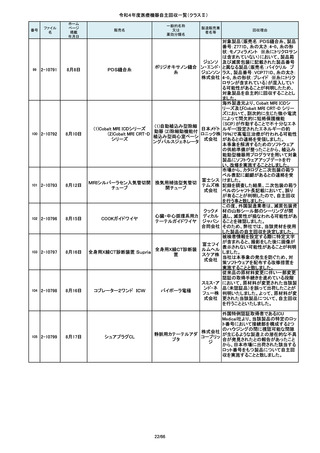
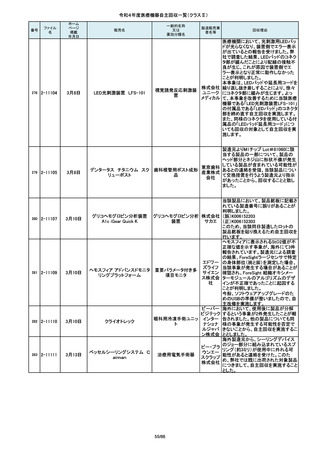
84
85
86
87
88
ファイル
名
2-10761
2-10763
2-10765
2-10766
2-10769
ホーム
ページ
掲載
年月日
7月20日
7月20日
7月20日
7月20日
7月21日
一般的名称
又は
薬効分類名
販売名
Carestation 750 シリーズ
麻酔システム
(1)血管撮影システム Trinias
(1),(2)据置型デジタル
(2)血管撮影システム
式循環器用X線透視診
BRANSIST safire
断装置,(3)X線管支持床
(3)循環器用Cアーム型保持
支持台
装置 MH-300
ブレスオーコレクト
超音波内視鏡下穿刺ニードル
シリコーンフォーリーカテーテル
製造販売業
者名等
回収理由
製造元からの連絡により、当該装置の
補助コモンガスアウトレットまたは補助
O2+AIRポートを使用する場合、ガスミ
GEヘルス キサーの不良が発生するおそれがあ
ケア・ジャ ることが分かりました。このため、製造
パン株式 元の情報を基に、お客様に情報提供を
会社 行うことで注意喚起を実施し、問題を
修正したソフトウェア及び圧力リリーフ
バルブに変更する改修作業を実施しま
す。
操作者により当該機器のCアームと検診台の天板を
所定の位置へ移動させていた時、移動のためのス
イッチから手を放したが、Cアームの移動は停止した
が検診台の上昇が停止しないという事象が発生しまし
た。
調査の結果、検診台の機械的動作を制御する基板
(以下”当該基板“とします。当該基板はCアームに搭
載)のソフトウェアに不具合があり、以下に示す、検診
台KS-70を組み込んだバイプレーン装置において、ご
くまれに当該事象が発生する可能性があることが判
明しました。そのため、自主改修を実施いたします。
(1)改修対象範囲設定について
1)血管撮影システム Trinias(以下Trinias)
Triniasは平成24年4月4日認証取得以降、継続して製
造販売しており、平成29年8月の一変申請時に当該基
板を変更しました。今回の不具合は変更後の当該基
板で発生することが分かっています。そのため、平成
30年4月以降に製造したバイプレーン装置に変更後の
株式会社 当該基板が搭載されていることから、上記製造番号の
製品を改修の対象と
島津製作 しています。また、それ以前に製造された装置におい
ても、当該基板に変更した装置は改修の対象となって
所
います。(*)
2)血管撮影システム BRANSIST safire(以下
BRANSIST safire)BRANSIST safireは平成18年8月8
日認証取得以降、継続して製造販売しています。新し
い機能などを提供することを目的に、納入している装
置の一部を交換する場合があり、その際、一部の装
置で不具合の原因となった当該基板に変更しておりま
す。製造時期が平成19年3月~平成24年7月の装置
において、平成30年4月以降に当該基板に変更したた
め改修の対象となっています。
3)循環器用Cアーム型保持装置 MH-300(以下MH300)MH-300はTriniasやBRANSIST safireにも構成さ
れるCアーム型保持装置ですが、個別に製造販売届
をしています。新しい機能などを提供することを目的
に、納入している装置の一部を交換する場合があり、
その際、一部の装置で不具合の原因となった当該基
板に変更しております。製造時期が平成20年10月~
平成24年9月の装置において、平成30年4月以降に当
該基板に変更したため改修の対象
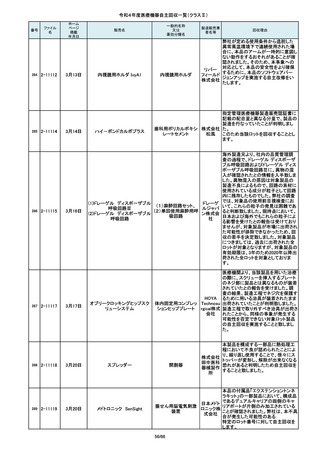
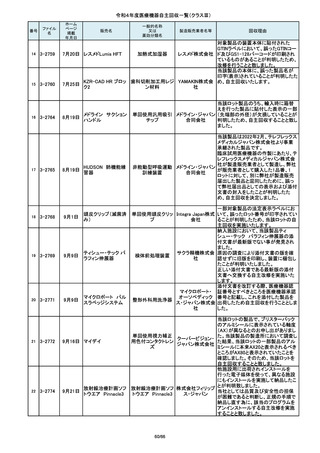
この度、製品パッケージの2種類の表
示規格(FT_41.5/TP_-1.50/DIA_10.6、
FT_42.0/TP_-2.00/DIA_10.6)の間
で一部製品を誤って梱包・出荷された
角膜矯正用コンタクトレ 株式会社 事実が判明いたしました。製造過程に
ンズ
シード おいて製品の取り違えが生じた可能
性が高いと判断し、出荷済みの該当
ロットについて自主回収を決定いたし
ました。
単回使用吸引用針
短期的使用泌尿器用
フォーリーカテーテル
19/66
国内の医療機関より、本品と併用した
超音波内視鏡において、使用後の洗
浄点検時に漏水が検知された事例が
複数報告されました。現在製造元にて
原因を調査中ではございますが、これ
センチュ
まで国内でのみ同事象の報告を受け
リーメディ
ていることから国内市場に出荷されて
カル株式
いるすべて製品について、同様の不具
会社
合の発生の可能性を否定出来ないた
め、自主回収を実施することとしまし
た。
市場より二次包装の箱ラベル表記に
誤記載があるとの連絡を受けました。
記録を調査した結果、対象ロット品に
富士シス のみ二次包装の箱ラベルの滅菌年
テムズ株 月、および使用期限に誤記載の有るこ
式会社 とが判明致しまので、自主回収を行う
事と致しました。