総-1○診療報酬改定結果検証部会からの報告について (284 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00169.html |
| 出典情報 | 中央社会保険医療協議会 総会(第532回 11/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
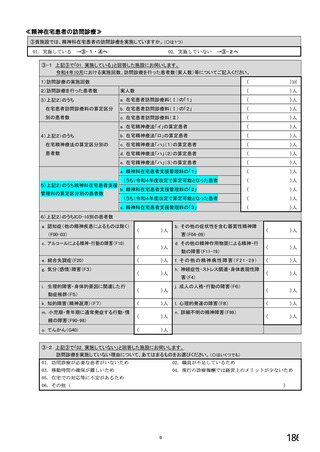
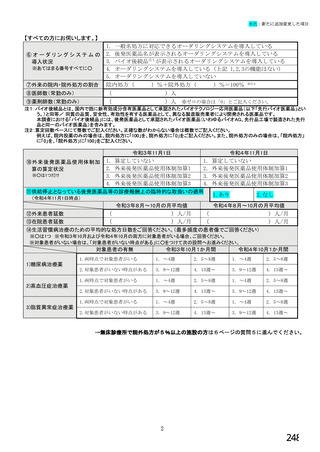
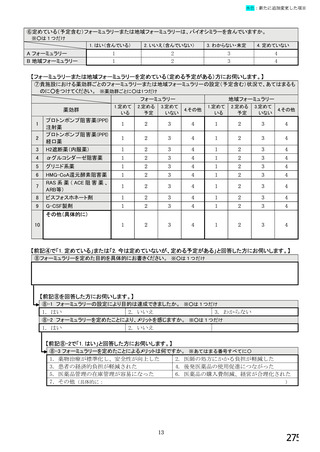
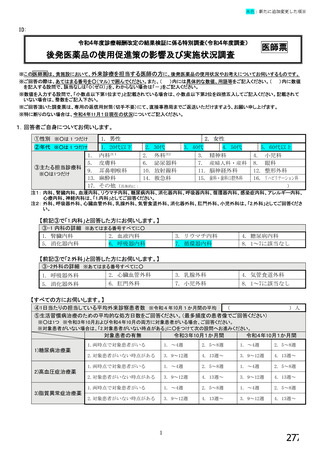
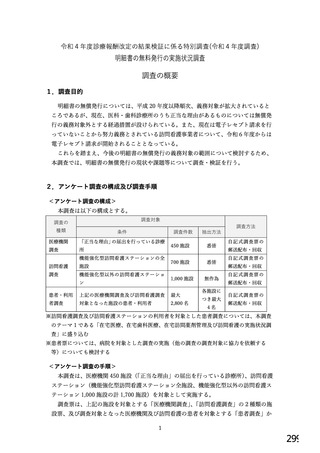
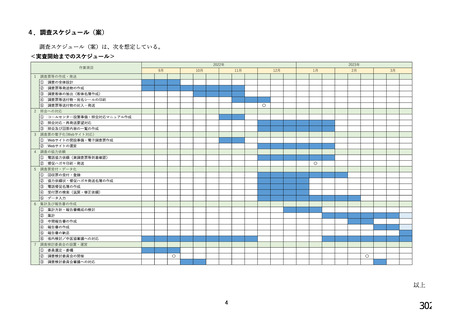
6.バイオ後続品の使用に関するお考えについてお伺いします。
注:バイオ後続品とは、国内で既に新有効成分含有医薬品として承認されたバイオテクノロジー応用医薬品(以下「先行バイ
オ医薬品」という。)と同等/ 同質の品質、安全性、有効性を有する医薬品として、異なる製造販売業者により開発さ
れる医薬品です。
本調査における「バイオ後続品」には、後発医薬品として承認されたバイオ医薬品(いわゆるバイオAG、先行品工場で製
造された先行品と同一のバイオ医薬品)を含みます。
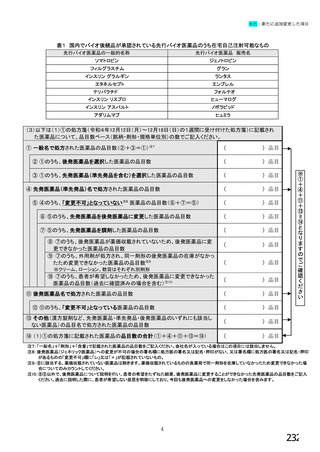
国内でバイオ後続品が承認されている先行バイオ医薬品
先行バイオ医薬品の一般的名称注1
先行バイオ医薬品 販売名
ソマトロピン
ジェノトロピン
エポエチン アルファ
エスポー
フィルグラスチム
グラン
インフリキシマブ
レミケード
インスリン グラルギン
ランタス
リツキシマブ
リツキサン
トラスツズマブ
ハーセプチン
エタネルセプト
エンブレル
アガルシダーゼ ベータ
ファブラザイム
ベバシズマブ
アバスチン
ダルベポエチン
テリパラチド
アルファ注2
ネスプ
フォルテオ
インスリン リスプロ
アダリムマブ
ヒューマログ
ヒュミラ
インスリン アスパルト
ラニビズマブ
ノボラピッド
ルセンティス
注1:(遺伝子組換え)を省略して記載
注2:バイオ後続品と、いわゆるバイオAGのそれぞれが承認されている
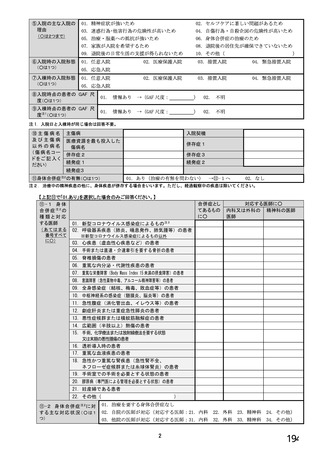
①貴施設では、バイオ後続品を採用していますか。 ※○は1つだけ
1. 採用している
2. 採用していない
3. わからない
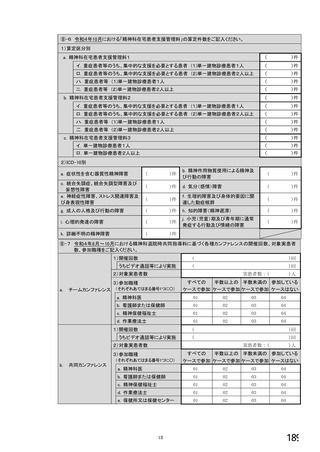
②ご担当の患者の中でバイオ後続品・先行バイオ医薬品の対象となる患者はいますか。 ※○は1つだけ
1. いる →質問③へ
2. いない →質問⑯へ
3. わからない →質問⑯へ
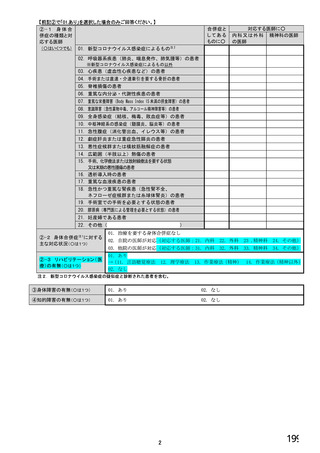
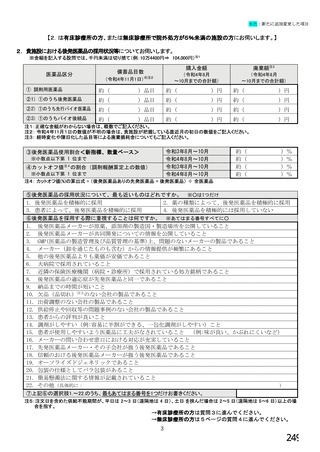
【前記②で「1.いる」と回答した方にお伺いします。】
③バイオ後続品・先行バイオ医薬品を使用する患者は、院内での使用と院外処方箋の発行のどちらでしょうか。
※あてはまる番号すべてに○
1. 院内(入院または院内の外来)で使用する患者がいる
2. 院外処方箋を発行する患者がいる
→質問④へ
→質問⑧へ
【前記③で「1. 院内(入院または院内の外来)で使用する患者がいる」と回答した方にお伺いします。】
④院内でバイオ後続品・先行バイオ医薬品の対象となる患者がいる場合、使用方針はいかがでしょうか。
※○は1つだけ
1.バイオ後続品が発売されているものは、積極的に使用する
2. 品質や有効性、安全性に疑問がないバイオ後続品は積極的に使用する
3. 安定供給に疑問がないバイオ後続品は積極的に使用する
4.品目によってはバイオ後続品を積極的に使用する
5.先行バイオ医薬品とバイオ後続品の適応症が同じ場合は積極的に使用する
6.バイオ後続品を積極的には使用していない →質問⑦へ
7. その他(具体的に:
8
)
→質問⑧へ
284