総-1○診療報酬改定結果検証部会からの報告について (270 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00169.html |
| 出典情報 | 中央社会保険医療協議会 総会(第532回 11/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
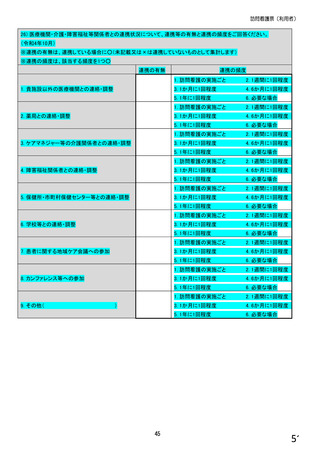
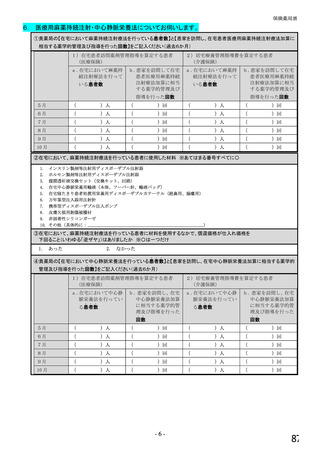
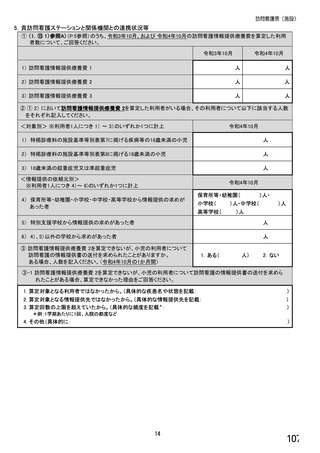
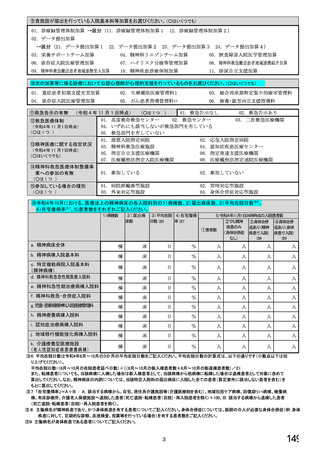
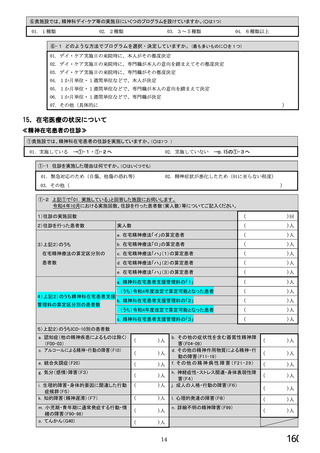
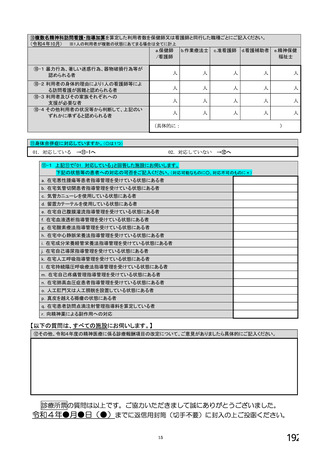
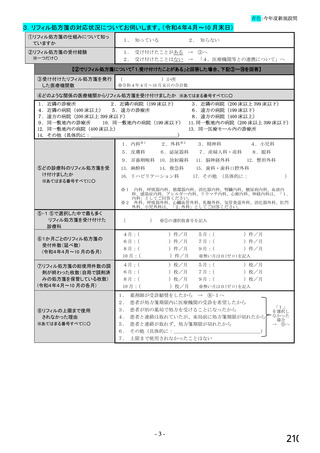
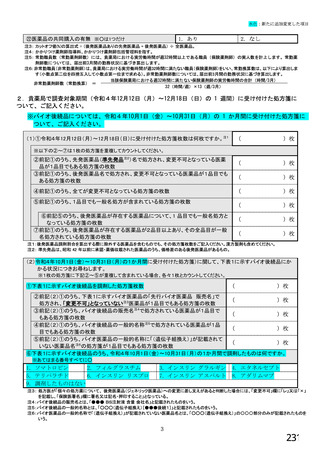
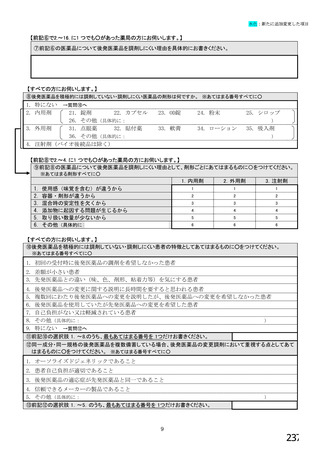
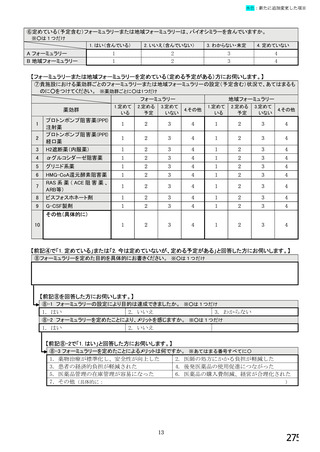
【前記①で「6.バイオ後続品を積極的には採用していない」と回答した方にお伺いします。】
③バイオ後続品を積極的には採用していない理由としてあてはまるものお選びください。 ※あてはまる番号すべてに○
1.
2.
バイオ後続品の品質や有効性、安全性に疑問があるから
バイオ後続品は、先発品(先行バイオ医薬品)と同等/同質の品質・安全性・有効性を有するが
同一ではないため
3. バイオ後続品に関する情報提供が不足しているから
→不足している情報(
)
4. バイオ後続品の品目が少ないから
5. バイオ後続品の安定供給に不安があるから
6. 患者への普及啓発が不足しているから
7. 患者の経済的メリットが小さいから
8. 高額療養費や公費医療費制度を利用している患者がいるから
9. 院内でバイオ後続品の投与や処方を行っていないから
10. 診療科からの要望がないから
11. 在庫管理等の負担が大きいから
12.先行バイオ医薬品の薬価差益がバイオ後続品の薬価差益よりも大きいから
13. 先行バイオ医薬品とバイオ後続品の両方を備蓄するのは困難だから
14. 製造販売後調査(PMS)の手間が大きいから
15. 先行バイオ医薬品とバイオ後続品の適応症が異なるから
16. 先行バイオ医薬品とバイオ後続品のデバイスのタイプが異なるから
17. その他(具体的に:
)
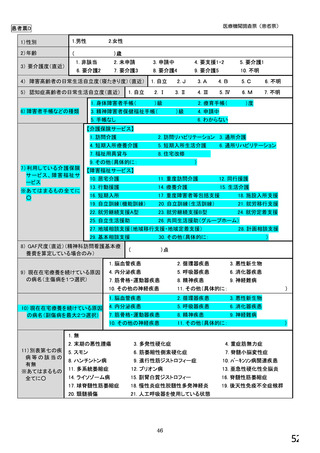
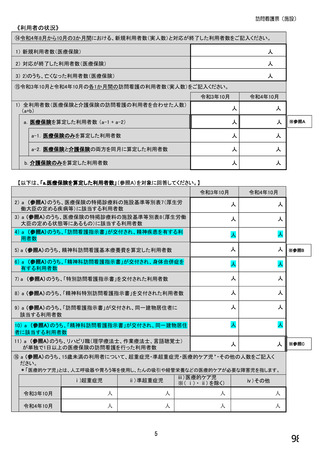
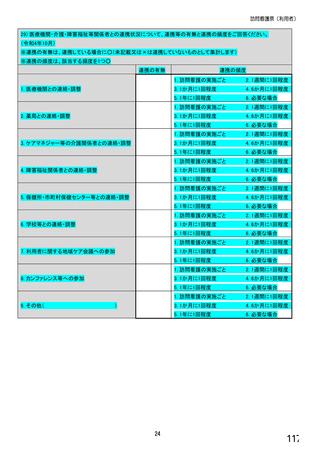
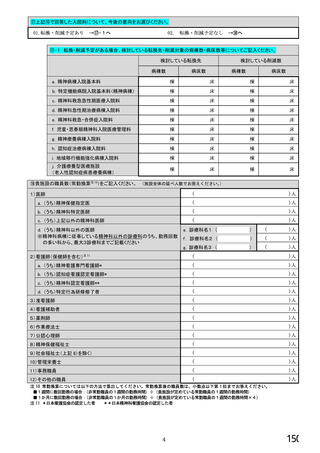
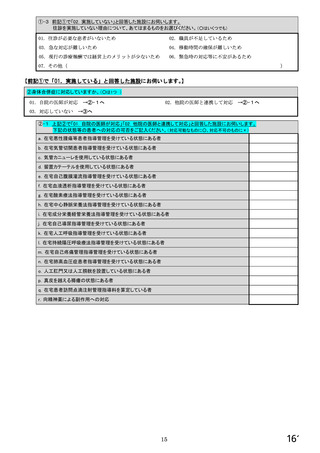
【すべての方にお伺いします。】
④貴施設では、外来患者に対して、バイオ後続品の院外処方箋を発行していますか。 ※○は1つだけ
※バイオ後続品の院外処方箋とは、バイオ後続品の製品名又は一般的名称で処方箋を発行する場合をいいます。
なお、バイオ後続品の院外処方箋発行の対象となるバイオ製品は在宅自己注射が可能な製品であり、現在使用できるバイオ後
続品は、インスリン製剤、ヒト成長ホルモン剤、エタネルセプト製剤、テリパラチド製剤です。
1.発行している
2. 発行していない →質問⑩へ
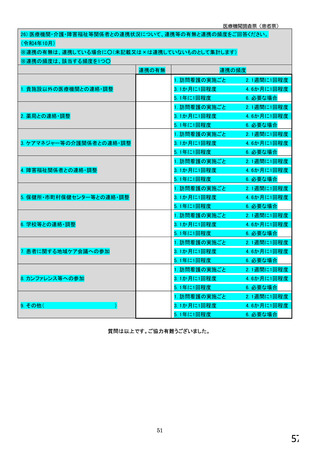
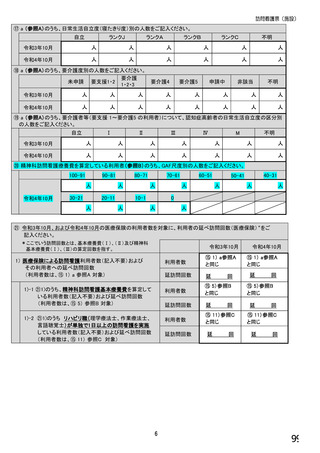
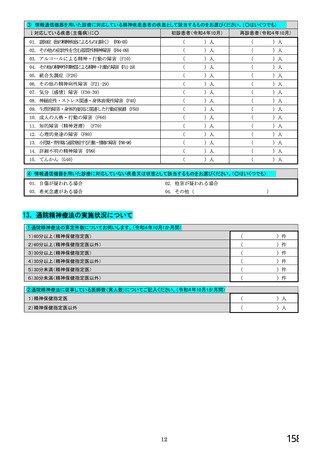
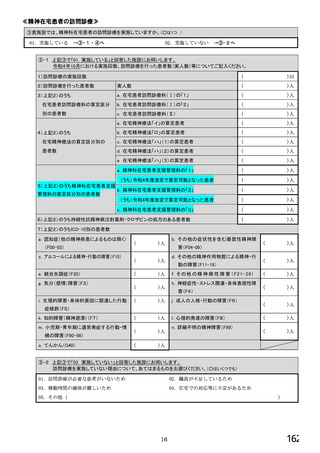
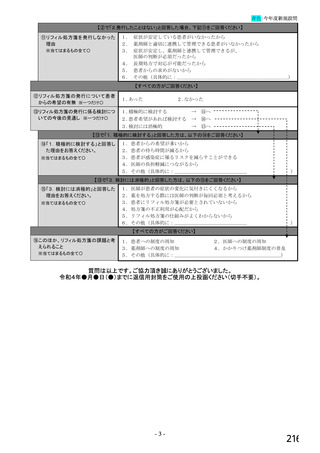
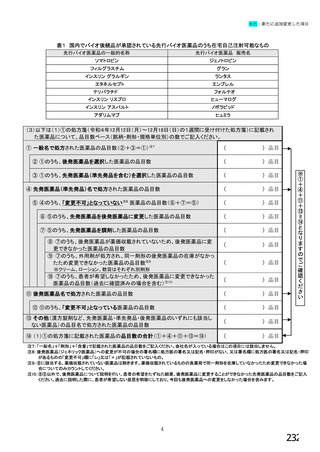
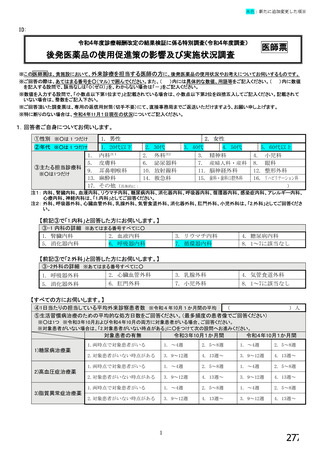
【⑤⑥は、前記④で「1.発行している」と回答した方にお伺いします。】
⑤発行する際、処方箋にどのように表記していますか。 ※○は1つだけ
1. バイオ後続品の販売名(例:「●●● BS注射液 含量 会社名」)
2. バイオ後続品の一般的名称(「○○○(遺伝子組換え)[●●●後続1]」)
3. バイオ後続品の一般的名称だが(遺伝子組換え)と記載しない(「○○○[●●●後続1]」)
4. 変更不可欄にチェックを入れずに先行品の販売名で処方
5. 変更不可欄にチェックを入れずに先行品の一般的名称で処方(「○○○(遺伝子組換え))
6. その他(具体的に:
)
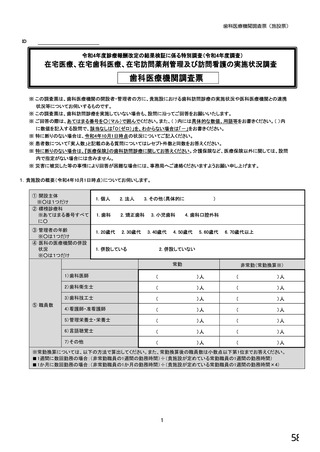
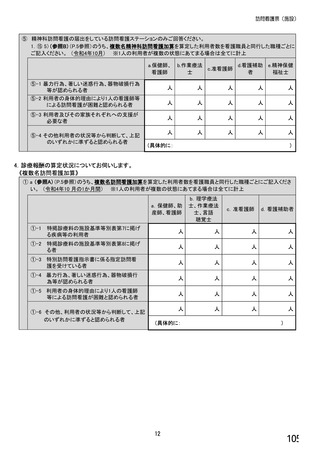
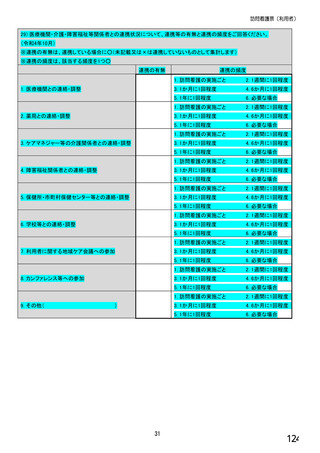
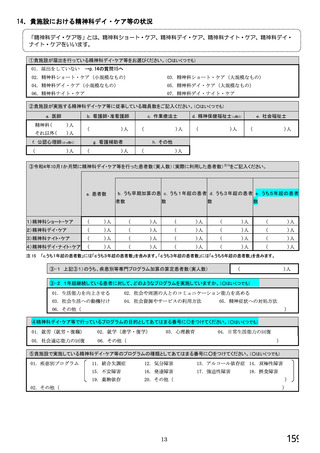
⑥バイオ後続品を院外処方するにあたって薬局・薬剤師に望むことはありますか。 ※あてはまる番号すべてに○
1. 「一般名処方の調剤」または「バイオ後続品への変更調剤」について、予め合意した方法で情報提
供を受けること
2. 「一般名処方の調剤」または「バイオ後続品への変更調剤」について、合意方法や頻度によらず情
報提供を受けること
3. 患者に対して、バイオ後続品の品質や有効性、安全性について説明を行うこと
4. 患者に対して、バイオ後続品の普及啓発を行うこと
5. その他(具体的に:
)
8
270