よむ、つかう、まなぶ。
総-4-2医療機器の保険適用等に関する取扱いについて(案) (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_70414.html |
| 出典情報 | 中央社会保険医療協議会 総会(第647回 2/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
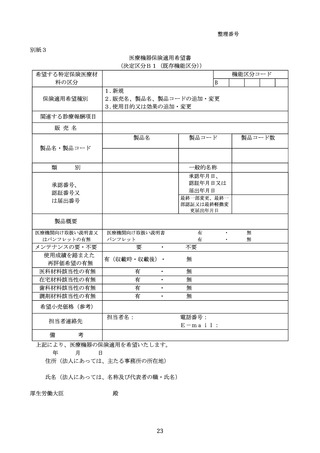
決定区分A2(特定包括)又はB1(既存機能区分)として希望のあった医療機器について、保
険適用等の決定を行った場合は、次の事項を地方厚生(支)局長等及び都道府県知事に対し通知す
る。
① 決定区分及び機能区分等
② 保険適用開始年月日
(6) 決定区分非A1(包括)
、非A2(特定包括)又は非B1(既存機能区分)の取扱い
①
決定区分A1(包括)
、A2(特定包括)又はB1(既存機能区分)として希望のあった医療
機器が当該区分に該当しないと判断した場合は、決定区分Fの場合を除き、それぞれ非A1(包
括)
、非A2(特定包括)又は非B1(既存機能区分)として決定する。
この場合、区分決定までの審査に係る標準的な事務処理期間の取扱いについては、上記2の
(2)と同様とする。
②
決定区分非A1(包括)
、非A2(特定包括)又は非B1(既存機能区分)として決定された
医療機器については、他の機能区分等による再希望を妨げない。
3
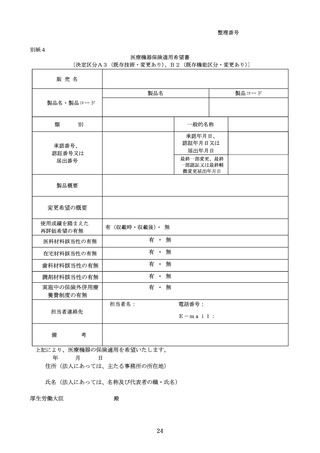
決定区分A3(既存技術・変更あり)又はB2(既存機能区分・変更あり)を希望する医療機器の
保険適用手続
(1) 保険適用希望書の提出
決定区分A3(既存技術・変更あり)又はB2(既存機能区分・変更あり)を希望する医療機器
の製造販売業者は、医薬品医療機器等法の規定に基づく承認又は認証を受けた後、又は届出(変更
計画に従った変更に係る届出を含む。)が受理された後、それぞれの区分に応じ別紙4に定める保
険適用希望書を提出すること。なお、変更計画に従った変更に係る届出に伴い保険適用希望書を提
出する場合、保険適用となる日が当該変更を行う日以降となるように保険適用希望書を提出し、当
該変更が行われなかった場合は、当該変更に係る保険適用希望書を取り下げること。提出に当たっ
ては、在宅材料、医科材料、歯科材料及び調剤材料それぞれの該当性の有無を明記すること。
また、新規収載後にチャレンジ申請を希望する医療機器の製造販売業者は、保険適用希望書の提
出時又は保険適用日から起算して1年を経過する日までに、チャレンジ申請による再評価を希望す
る内容について、保険適用後にデータを収集する方法及び評価方法に係る計画の参考となる資料を
併せて提出すること。ただし、チャレンジ申請による再評価の対象は、チャレンジ権の取得後に製
造販売業者が関与の上で収集したデータ(チャレンジ権の取得時点ですでに収集を開始しているも
のも含む。)に基づき、査読付き論文として公表されたものに限られ、独自の解析等は対象となら
ないこと。また、評価方法に係る計画については、原則として比較試験を求める。比較試験の実施
が困難な場合には、バイアスのリスクを軽減する方法等を十分に検討した研究計画を示すこと。な
6
険適用等の決定を行った場合は、次の事項を地方厚生(支)局長等及び都道府県知事に対し通知す
る。
① 決定区分及び機能区分等
② 保険適用開始年月日
(6) 決定区分非A1(包括)
、非A2(特定包括)又は非B1(既存機能区分)の取扱い
①
決定区分A1(包括)
、A2(特定包括)又はB1(既存機能区分)として希望のあった医療
機器が当該区分に該当しないと判断した場合は、決定区分Fの場合を除き、それぞれ非A1(包
括)
、非A2(特定包括)又は非B1(既存機能区分)として決定する。
この場合、区分決定までの審査に係る標準的な事務処理期間の取扱いについては、上記2の
(2)と同様とする。
②
決定区分非A1(包括)
、非A2(特定包括)又は非B1(既存機能区分)として決定された
医療機器については、他の機能区分等による再希望を妨げない。
3
決定区分A3(既存技術・変更あり)又はB2(既存機能区分・変更あり)を希望する医療機器の
保険適用手続
(1) 保険適用希望書の提出
決定区分A3(既存技術・変更あり)又はB2(既存機能区分・変更あり)を希望する医療機器
の製造販売業者は、医薬品医療機器等法の規定に基づく承認又は認証を受けた後、又は届出(変更
計画に従った変更に係る届出を含む。)が受理された後、それぞれの区分に応じ別紙4に定める保
険適用希望書を提出すること。なお、変更計画に従った変更に係る届出に伴い保険適用希望書を提
出する場合、保険適用となる日が当該変更を行う日以降となるように保険適用希望書を提出し、当
該変更が行われなかった場合は、当該変更に係る保険適用希望書を取り下げること。提出に当たっ
ては、在宅材料、医科材料、歯科材料及び調剤材料それぞれの該当性の有無を明記すること。
また、新規収載後にチャレンジ申請を希望する医療機器の製造販売業者は、保険適用希望書の提
出時又は保険適用日から起算して1年を経過する日までに、チャレンジ申請による再評価を希望す
る内容について、保険適用後にデータを収集する方法及び評価方法に係る計画の参考となる資料を
併せて提出すること。ただし、チャレンジ申請による再評価の対象は、チャレンジ権の取得後に製
造販売業者が関与の上で収集したデータ(チャレンジ権の取得時点ですでに収集を開始しているも
のも含む。)に基づき、査読付き論文として公表されたものに限られ、独自の解析等は対象となら
ないこと。また、評価方法に係る計画については、原則として比較試験を求める。比較試験の実施
が困難な場合には、バイアスのリスクを軽減する方法等を十分に検討した研究計画を示すこと。な
6