よむ、つかう、まなぶ。
資料4 Ⅳ-112,140_メトトレキサート[1.5MB] (61 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00045.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第67回 2/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
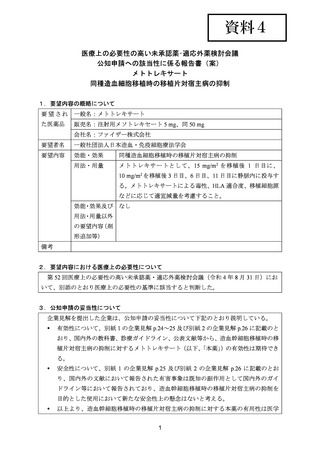
(公知申請への該当性に係る企業見解の様式)
要望番号;IV-140
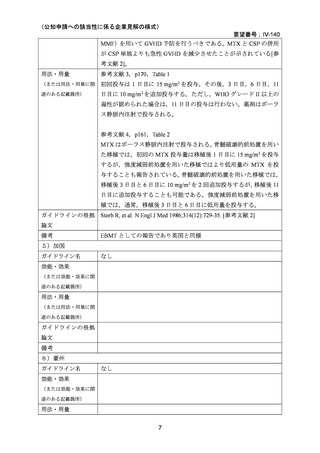
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
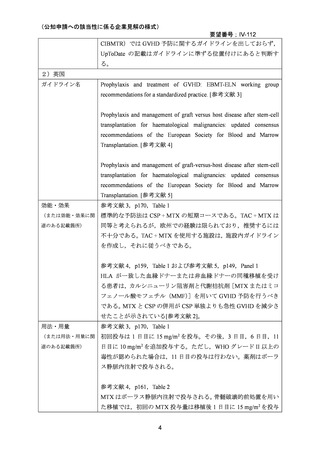
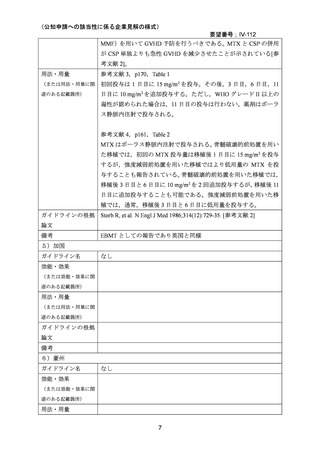
国内外の文献において,他の GVHD 予防治療と比較して口腔粘膜炎の重症度が高い 18,
GVHD に関連しない間質性肺炎による死亡が認められた 8 等の報告があったが,感染症,
間質性肺炎等の発現頻度については対照群と大きな違いがなかった 9 との報告もみられた。
国内外のガイドライン,教科書等においては,MTX の使用による生着の遅れや粘膜炎 20・
口内炎,肝障害,骨髄抑制 36 等が副作用として挙げられている。
MTX の静脈内投与は,白血病,乳がん,尿路上皮癌を適応としてすでに長い使用経験があ
り,添付文書において重要な基本的注意として上記疾患についても注意喚起がなされてお
り,GVHD の予防を目的とした使用において,新たな安全性上の懸念はないと考える。7.
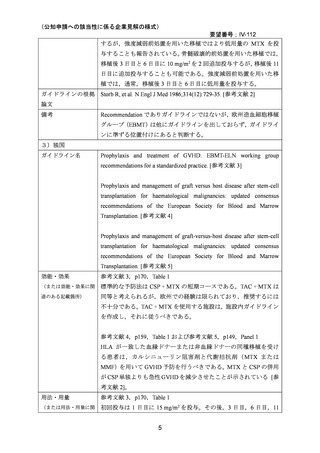
(1)で述べたとおり,これまでに報告されている無作為化試験,後ろ向き研究,データ
ベース研究では小児患者も含めて評価されている報告も多いが,小児特有の安全性の懸念
は指摘されていない。
(3)要望内容に係る公知申請の妥当性について
上記(1)および(2)を踏まえ,小児患者における GVHD の予防において MTX の有効
性や安全性は,医学薬学上公知であると考える。したがって,これらのエビデンスを用い
ることで,追加の臨床試験等を実施することなく,公知申請を行うことが妥当であると判
断した。
8.効能・効果及び用法・用量等の記載の妥当性について
(1)効能・効果について
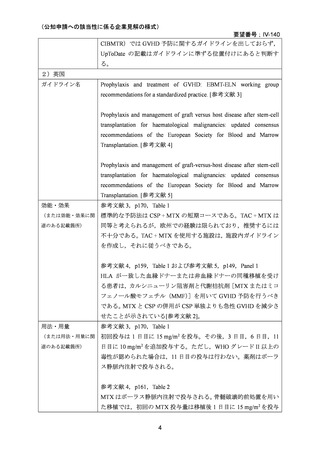
MTX は国内外いずれにおいても同種造血細胞移植時の GVHD の予防の治療薬としては承
認されていないものの,国内外の教科書 30,31,32,33,34,35,ガイドライン 1,3,4,5,36 で,GVHD の予
防としてカルシニューリン阻害剤(CSP または TAC)と MTX(短期投与)の併用が推奨さ
れている。
無作為化試験として,CSP と MTX の短期投与(移植後 1 日目に 15 mg/m2,3,6,11 日目
に 10 mg/m2)の併用群と CSP 単独投与群との比較で GVHD 予防の効果が報告されている
2,14,18
。また,他のカルシニューリン阻害剤として TAC を MTX(短期投与)併用下で CSP
と比較する第 3 相無作為化試験が実施され,急性 GVHD の減少が認められたものの,慢性
GVHD,再発,全生存率には差がなかったことが報告されている 22,23。
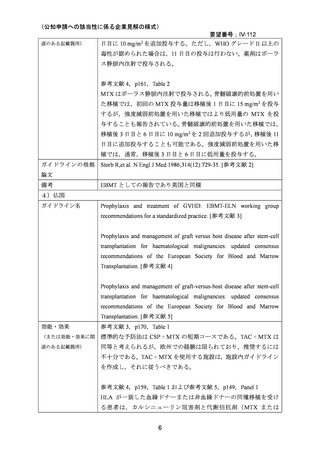
これらの無作為化試験は骨髄移植を受けた患者を対象としているが,メタ・アナリシスの
報告においては,末梢血幹細胞移植,造血細胞移植を受けた患者を対象としたレビューも
行われている 27,29。
小児のみを対象とした無作為化試験は報告されていないが,上記の試験の多くは 18 歳未満
の患者が組み入れられ,成人とともに評価されている。
26
要望番号;IV-140
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
国内外の文献において,他の GVHD 予防治療と比較して口腔粘膜炎の重症度が高い 18,
GVHD に関連しない間質性肺炎による死亡が認められた 8 等の報告があったが,感染症,
間質性肺炎等の発現頻度については対照群と大きな違いがなかった 9 との報告もみられた。
国内外のガイドライン,教科書等においては,MTX の使用による生着の遅れや粘膜炎 20・
口内炎,肝障害,骨髄抑制 36 等が副作用として挙げられている。
MTX の静脈内投与は,白血病,乳がん,尿路上皮癌を適応としてすでに長い使用経験があ
り,添付文書において重要な基本的注意として上記疾患についても注意喚起がなされてお
り,GVHD の予防を目的とした使用において,新たな安全性上の懸念はないと考える。7.
(1)で述べたとおり,これまでに報告されている無作為化試験,後ろ向き研究,データ
ベース研究では小児患者も含めて評価されている報告も多いが,小児特有の安全性の懸念
は指摘されていない。
(3)要望内容に係る公知申請の妥当性について
上記(1)および(2)を踏まえ,小児患者における GVHD の予防において MTX の有効
性や安全性は,医学薬学上公知であると考える。したがって,これらのエビデンスを用い
ることで,追加の臨床試験等を実施することなく,公知申請を行うことが妥当であると判
断した。
8.効能・効果及び用法・用量等の記載の妥当性について
(1)効能・効果について
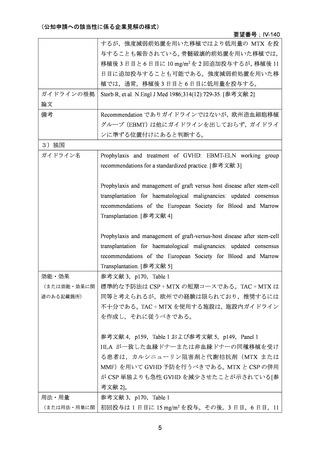
MTX は国内外いずれにおいても同種造血細胞移植時の GVHD の予防の治療薬としては承
認されていないものの,国内外の教科書 30,31,32,33,34,35,ガイドライン 1,3,4,5,36 で,GVHD の予
防としてカルシニューリン阻害剤(CSP または TAC)と MTX(短期投与)の併用が推奨さ
れている。
無作為化試験として,CSP と MTX の短期投与(移植後 1 日目に 15 mg/m2,3,6,11 日目
に 10 mg/m2)の併用群と CSP 単独投与群との比較で GVHD 予防の効果が報告されている
2,14,18
。また,他のカルシニューリン阻害剤として TAC を MTX(短期投与)併用下で CSP
と比較する第 3 相無作為化試験が実施され,急性 GVHD の減少が認められたものの,慢性
GVHD,再発,全生存率には差がなかったことが報告されている 22,23。
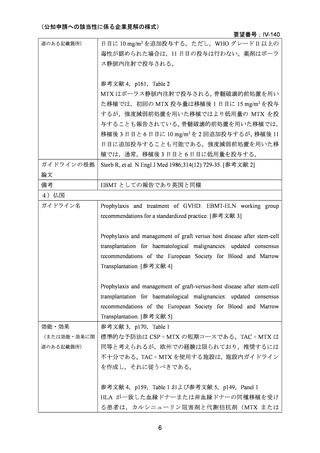
これらの無作為化試験は骨髄移植を受けた患者を対象としているが,メタ・アナリシスの
報告においては,末梢血幹細胞移植,造血細胞移植を受けた患者を対象としたレビューも
行われている 27,29。
小児のみを対象とした無作為化試験は報告されていないが,上記の試験の多くは 18 歳未満
の患者が組み入れられ,成人とともに評価されている。
26