会議資料 (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00043.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第65回 9/29)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
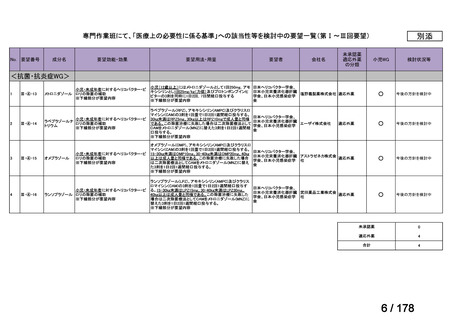
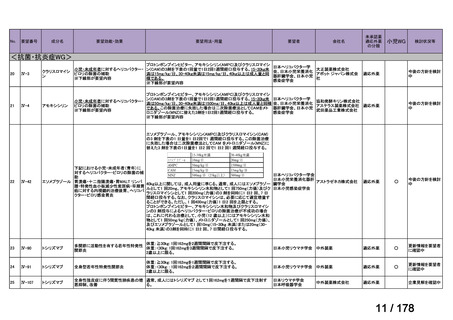
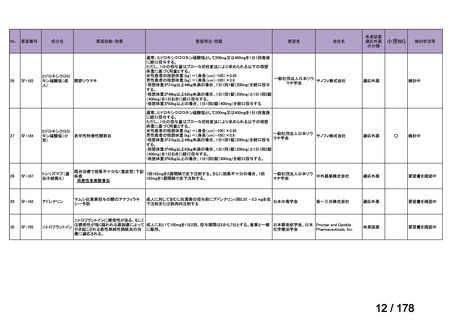
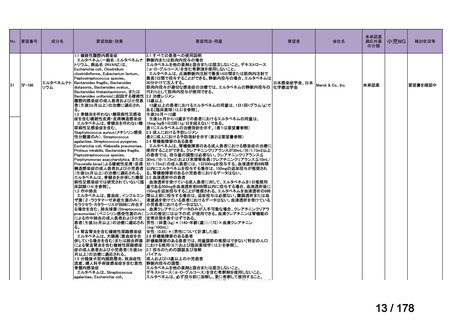
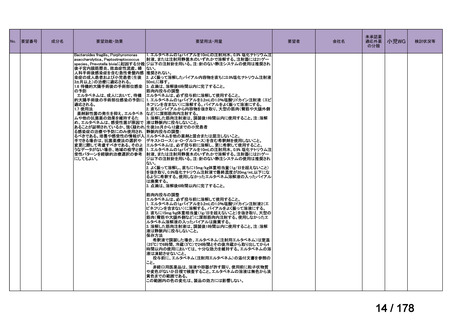
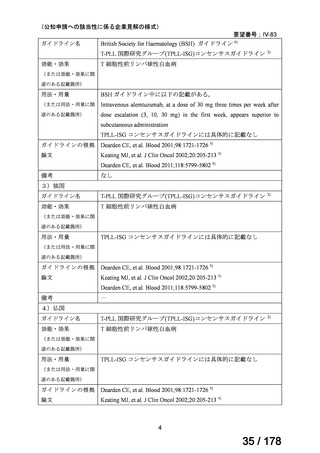
要望番号;IV-83
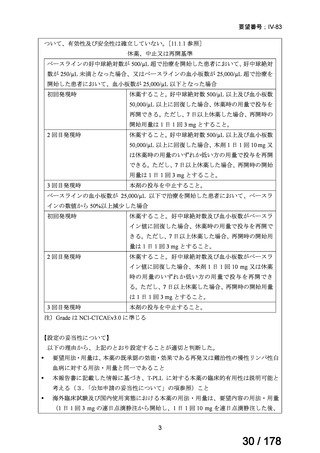
2 例は白血病細胞浸潤によるものと考えられた)であった。
4)海外第 II 相試験(NCCN Clinical Practice Guidelines in Oncology、T-PLL 国際研究グルー
プ(TPLL-ISG)コンセンサスガイドライン及び BSH ガイドラインの引用文献)
Dearden CE, et al. Blood 2011;118:5799-5802 5)
試験概要:未治療例 T-PLL においてアレムツズマブ皮下注単剤療法を行う第 2 相試験
(UKCLL05 試験)の報告である。皮下注が行われた 9 名と、同じ時期に同じ用量で静注で治
療された未治療 T-PLL 患者 32 名で効果が比較された。年齢中央値は皮下注 61 歳、静注 62
歳、髄外病変(皮膚、肝臓、中枢神経、消化管等)有の割合はそれぞれ 44%、42%であった。
用法・用量:アレムツズマブ皮下注の用量は最初の 3 日間で段階的に増量され(3 mg、10
mg、30 mg)、その後 30 mg を週 3 回、最大効果が得られるまで最大 18 週間投与された。
注射部位に重度の局所反応が発生した場合、疾患が進行した場合、又は 8 週目までに部分
奏功のみが達成された場合は、静注投与への変更が許可された。
有効性:全奏効割合は皮下注 33% (3/9)、静注 91% (29/32)、完全奏効割合は皮下注 33% (3/9)、
静注 81% (26/32)、12 ヶ月時点での無増悪生存割合は皮下注 67%、静注 67%、幹細胞移植割
合は皮下注 55%、静注 50%、48 ヶ月時点での全生存割合は皮下注 33%、静注 37%であっ
た。アレムツズマブは静注の方が奏効割合が高いことが示唆された。
安全性:アレムツズマブ皮下注は概ね忍容性良好であったが、2 例に皮膚反応、2 例に無症
候性サイトメガロウイルス再活性化、2 例にグレード 4 血液学的毒性(疾患関連と考えら
れる)が発生した。後者 2 例は治療中に進行性疾患により死亡した。アレムツズマブ静注
の安全性データの詳細は記載されていない。
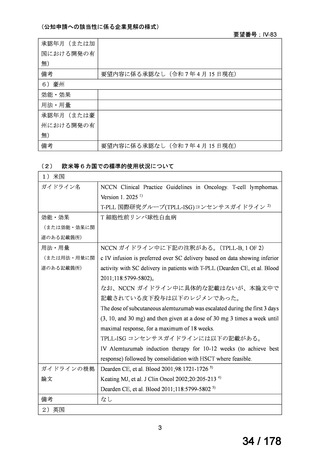
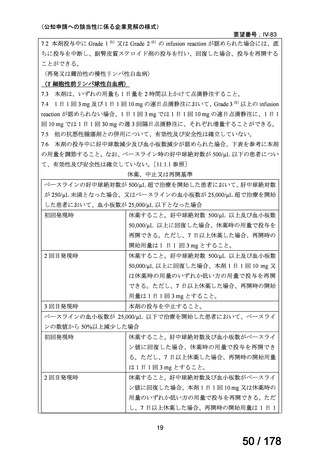
5)海外第 II 相試験
Hopfinger G, et al. Cancer 2013;119:2258-2267. 10)
試験概要:未治療・既治療の T-PLL 患者を対象とした第 II 相試験。FMC 療法(フルダラビ
ン、ミトキサントロン、シクロホスファミド)を最大 4 サイクル行い、アレムツズマブを
地固め療法として最大 12 週行う。全体で 25 名であり、うち 9 名は既治療、16 名は未治療
であった。登録された患者のうち 21 名がアレムツズマブの投与を受けた。
用法・用量:アレムツズマブは 1 日目に 3 mg、忍容性が良好であれば 2 日目に 10 mg、3 日
目に 30 mg に増量され、すべて 2 時間かけて点滴静注された。その後、すべての患者は地
固め療法としてアレムツズマブ 30 mg を週 3 回、最大 12 週間投与された。
有効性:FMC 療法の奏効割合は 68%で、完全奏効は 6 名、アレムツズマブの投与により奏
効割合は 92%(完全奏効 12 名、部分奏効 11 名)となった。アレムツズマブが投与された
患者での 50%生存期間は 17.1 ヶ月、50%無増悪生存期間は 11.9 ヶ月。
安全性:有害事象としては血液毒性が多かったが、アレムツズマブの投与を受けた 21 例に
限定すると、サイトメガロウイルスの再活性化が 13 例にみられ、うち 9 例は臨床的な感染
症に至った。治療関連死は 2 例で、1 例は二次がん、もう 1 例は冠動脈疾患の既往がある
8
39 / 178