会議資料 (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00043.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第65回 9/29)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
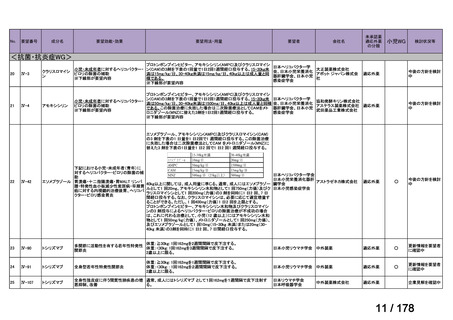
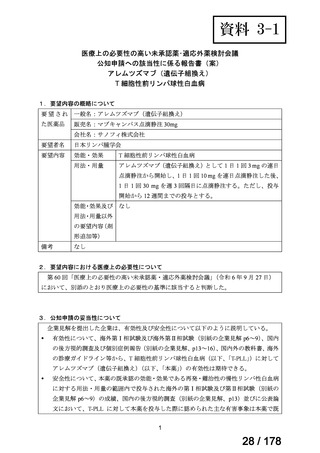
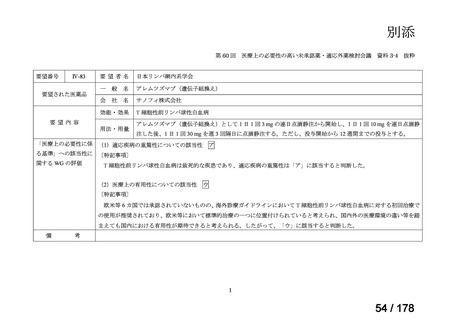
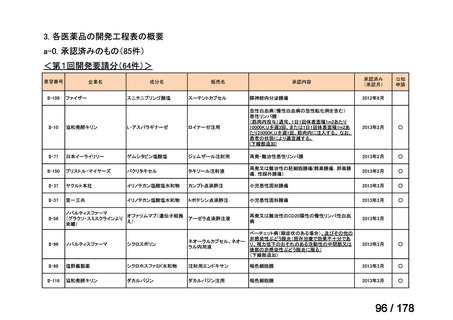
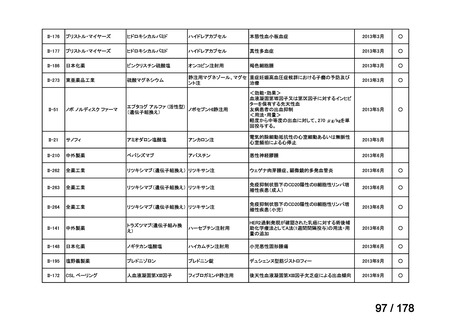
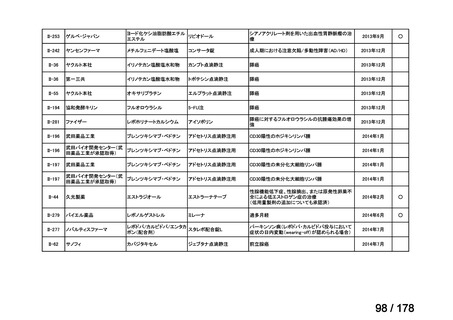
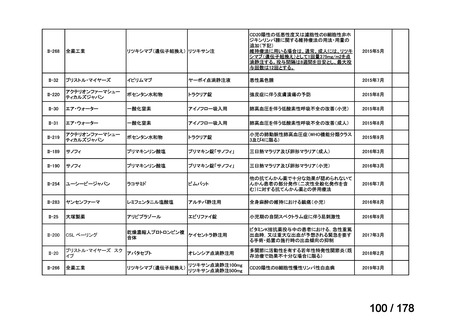
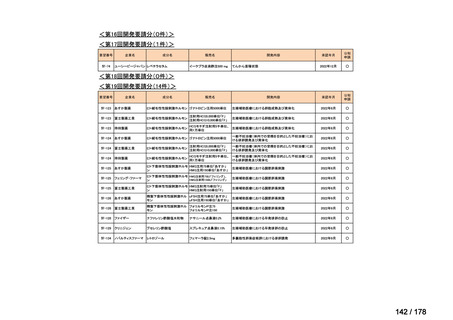
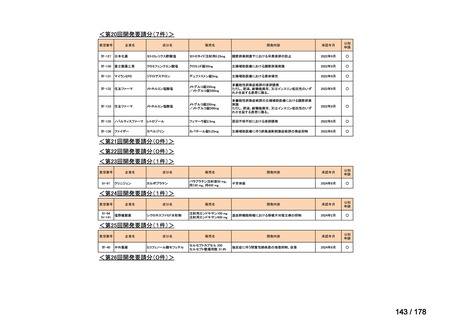
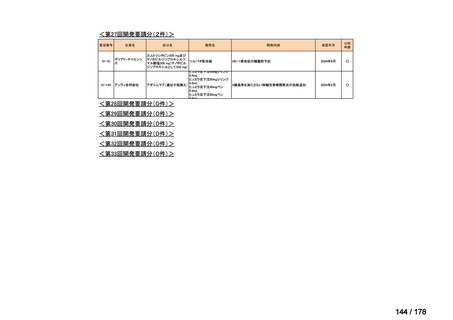
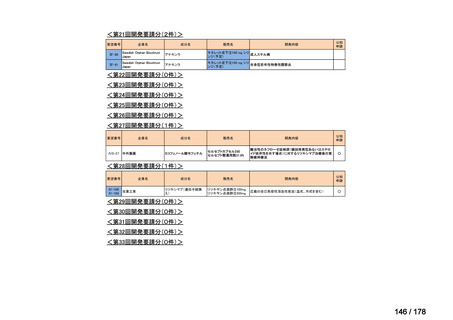
要望番号;IV-83
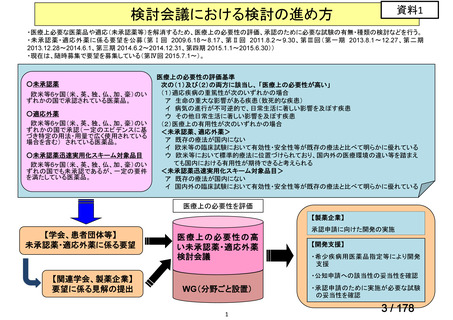
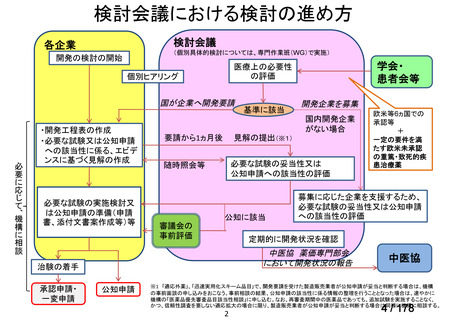
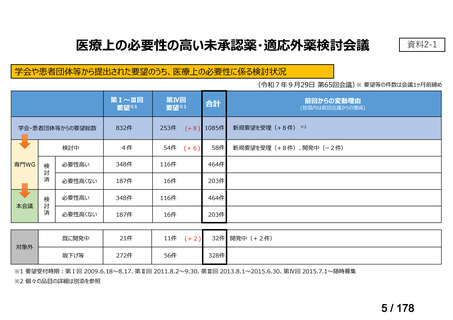
医療上の必要性の高い未承認薬・適応外薬検討会議
公知申請への該当性に係る報告書(案)
アレムツズマブ(遺伝子組換え)
T 細胞性前リンパ球性白血病
1.要望内容の概略について
要 望 さ れ 一般名:アレムツズマブ(遺伝子組換え)
た医薬品
販売名:マブキャンパス点滴静注 30mg
会社名:サノフィ株式会社
要望者名
日本リンパ腫学会
要望内容
効能・効果
T 細胞性前リンパ球性白血病
用法・用量
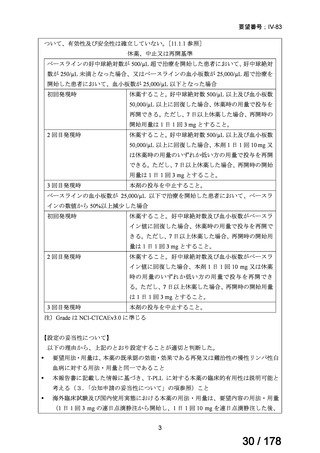
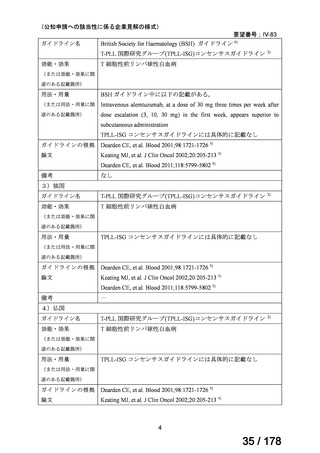
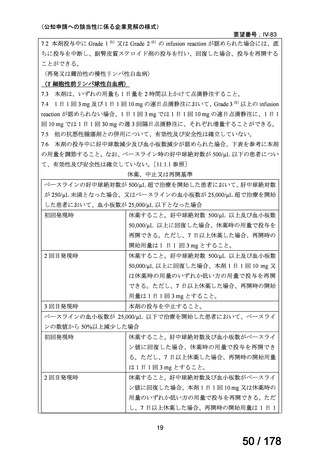
アレムツズマブ(遺伝子組換え)として 1 日 1 回 3 mg の連日
点滴静注から開始し、1 日 1 回 10 mg を連日点滴静注した後、
1 日 1 回 30 mg を週 3 回隔日に点滴静注する。ただし、投与
開始から 12 週間までの投与とする。
効能・効果及び なし
用法・用量以外
の要望内容(剤
形追加等)
備考
なし
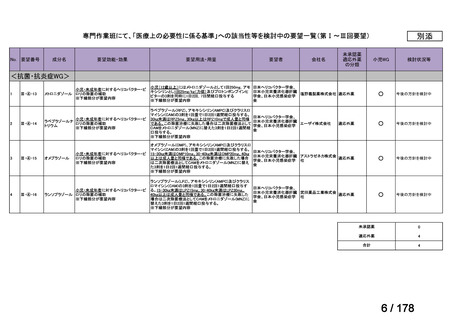
2.要望内容における医療上の必要性について
第 60 回「医療上の必要性の高い未承認薬・適応外薬検討会議」(令和 6 年 9 月 27 日)
において、別添のとおり医療上の必要性の基準に該当すると判断した。
3.公知申請の妥当性について
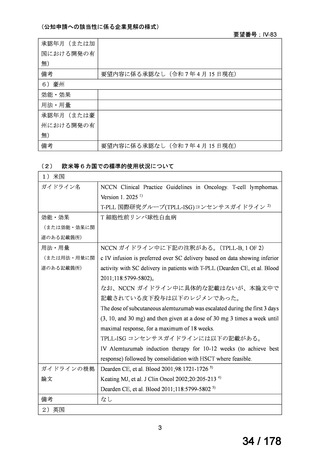
企業見解を提出した企業は、有効性及び安全性について以下のように説明している。
有効性について、海外第Ⅰ相試験及び海外第Ⅱ相試験(別紙の企業見解 p6~9)、国内
の後方視的調査及び個別症例報告(別紙の企業見解、p13~16)
、国内外の教科書、海外
の診療ガイドライン等から、T 細胞性前リンパ球性白血病(以下、
「T-PLL」)に対して
アレムツズマブ(遺伝子組換え)(以下、
「本薬」
)の有効性は期待できる。
安全性について、本薬の既承認の効能・効果である再発・難治性の慢性リンパ性白血病
に対する用法・用量の範囲内で投与された海外の第Ⅰ相試験及び第Ⅱ相試験(別紙の
企業見解 p6~9)の成績、国内の後方視的調査(別紙の企業見解、p13)並びに公表論
文において、T-PLL に対して本薬を投与した際に認められた主な有害事象は本薬で既
1
28 / 178