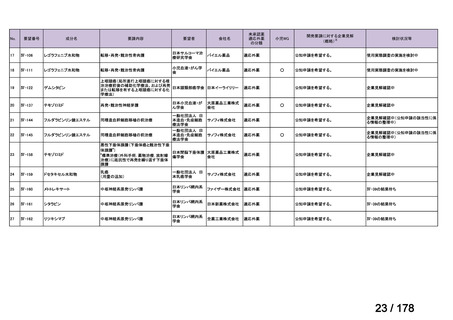
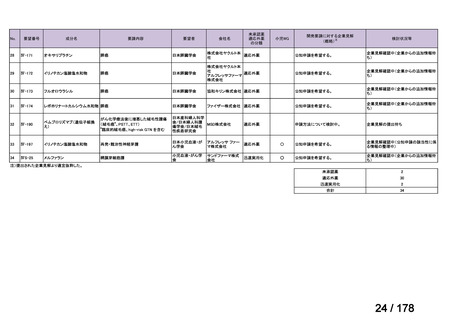
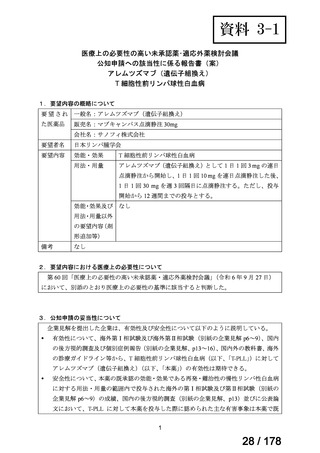
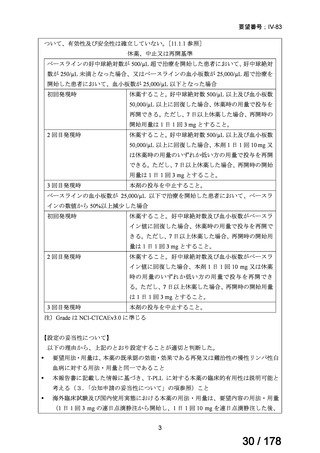
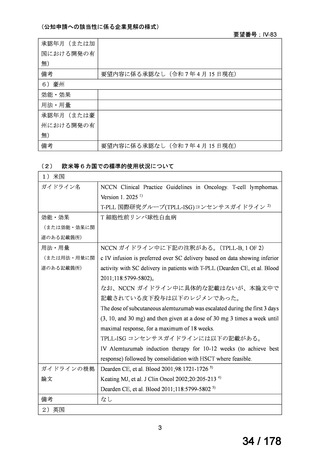
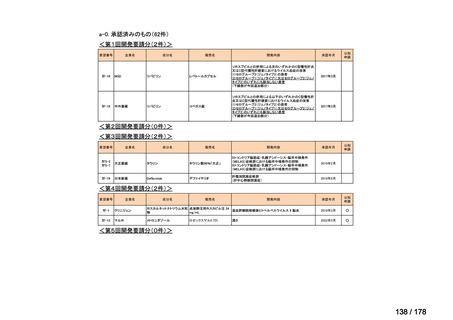
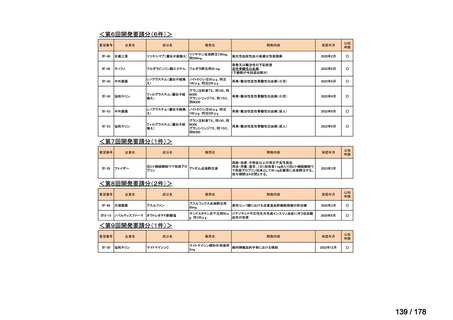
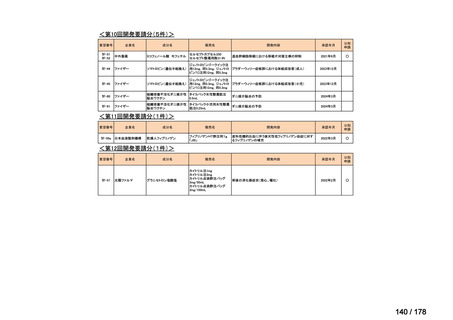
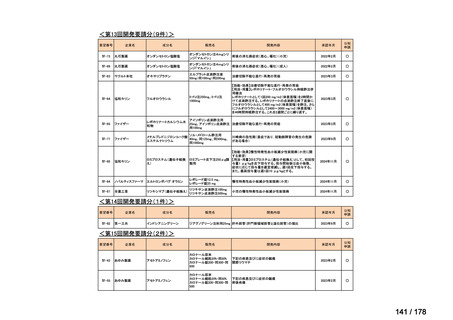
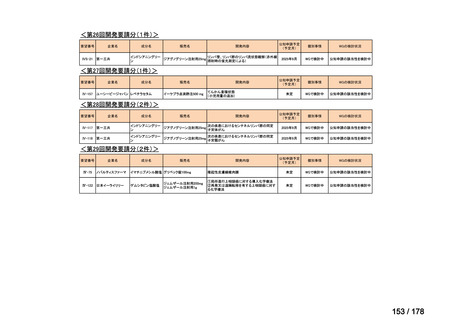
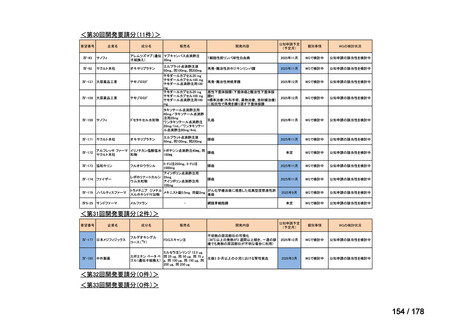
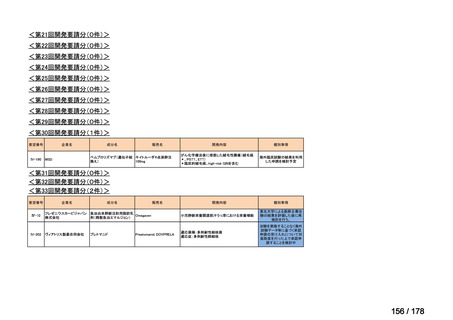
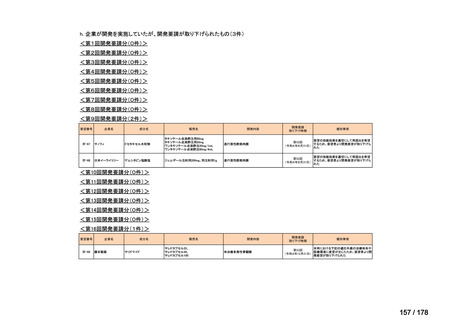
会議資料 (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00043.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第65回 9/29)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
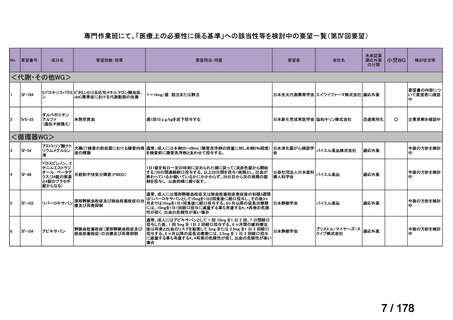
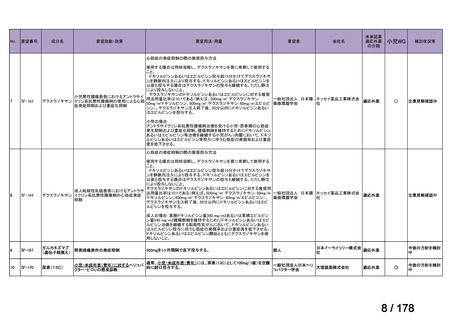
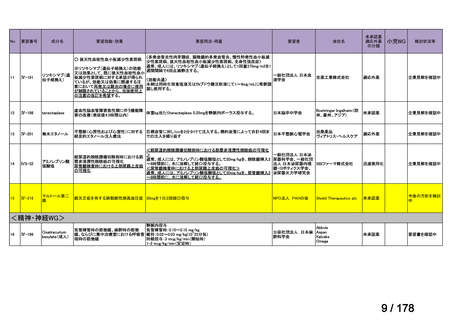
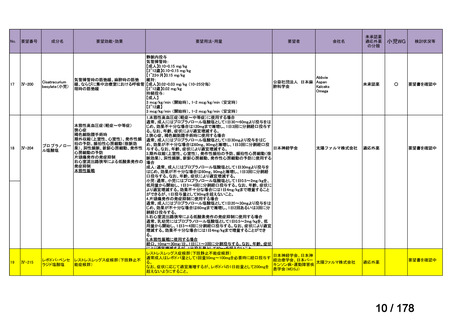
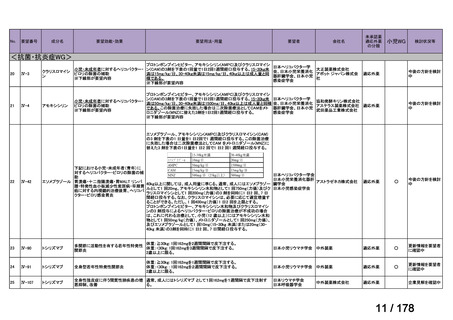
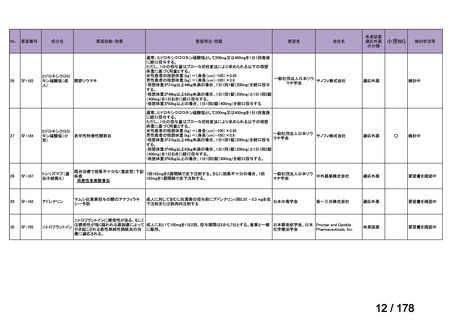
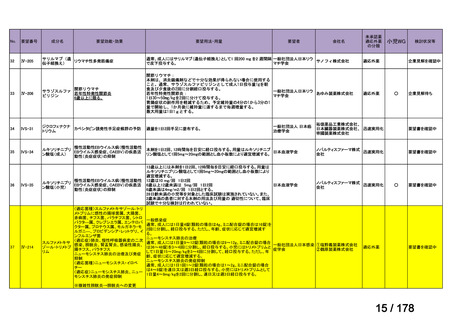
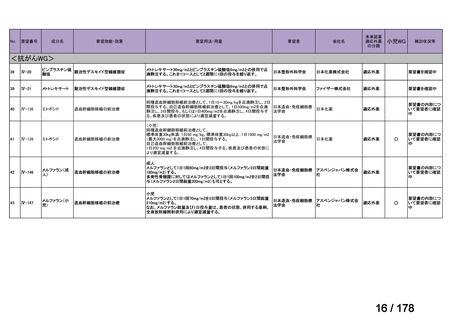
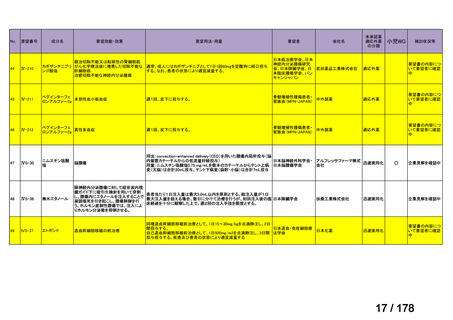
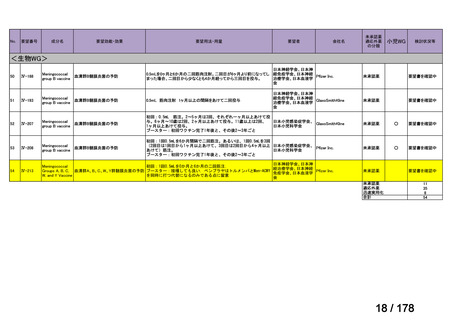
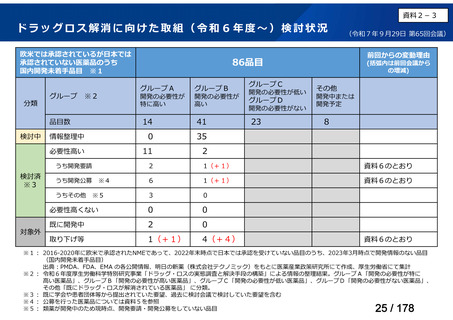
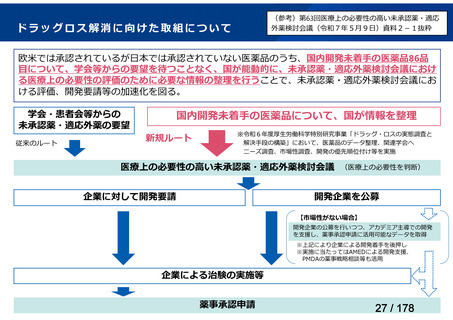
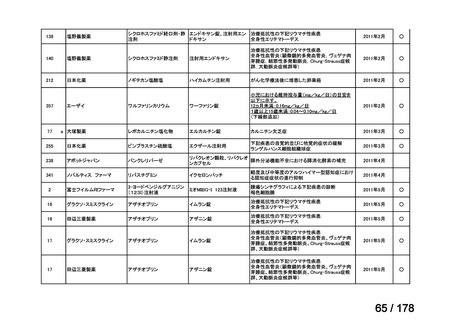
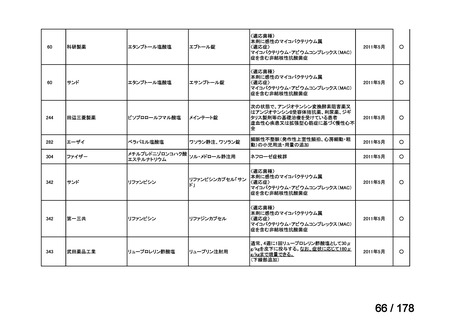
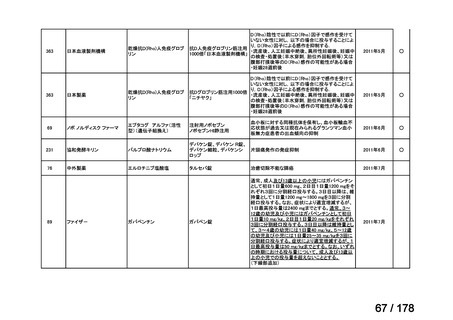
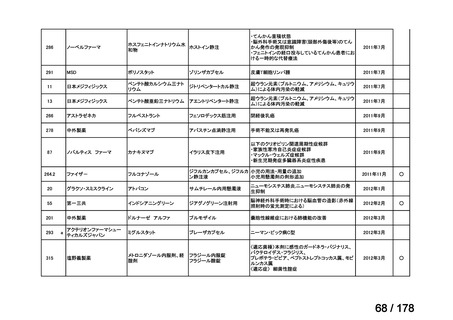
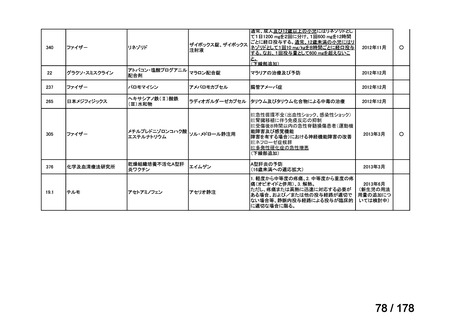
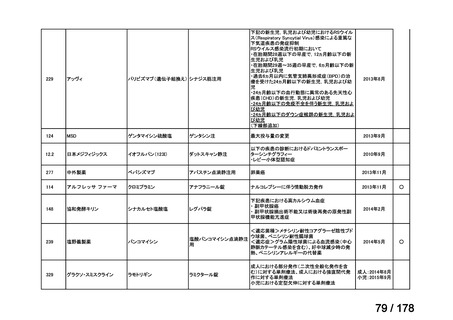
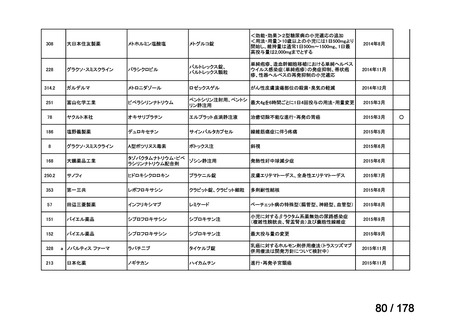
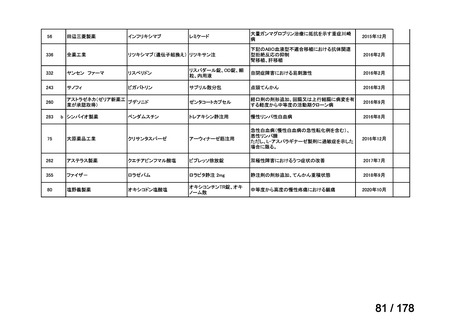
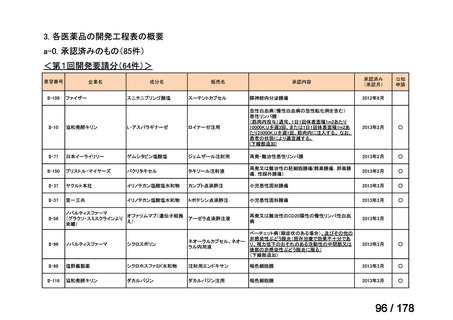
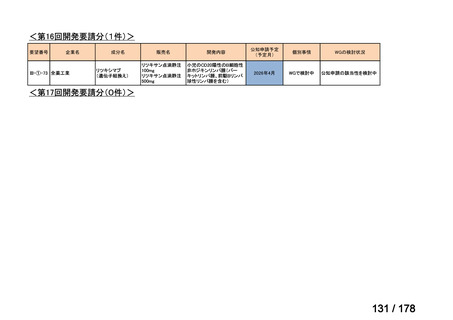
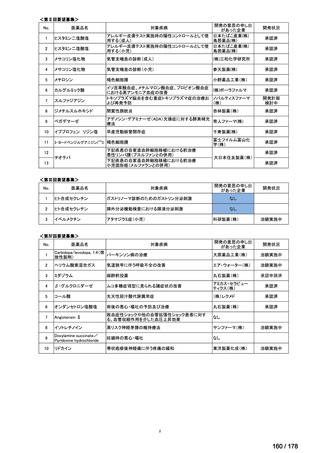
欧米では承認されているが日本では
承認されていない医薬品のうち
国内開発未着手品目 ※1
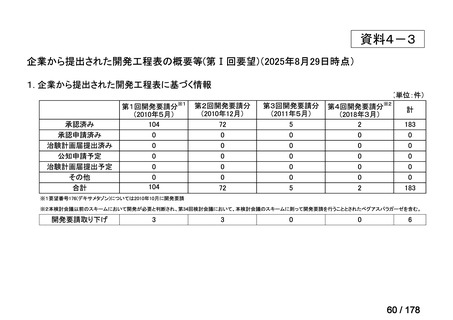
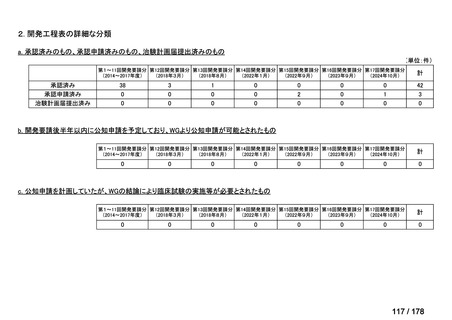
分類
グループ
開発の必要性が
特に高い
検討中
情報整理中
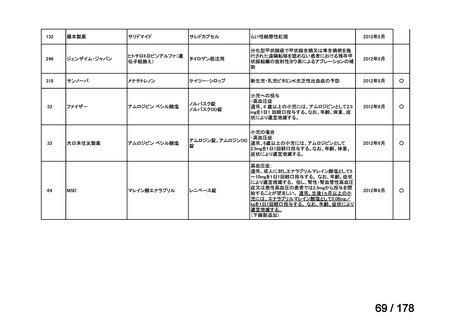
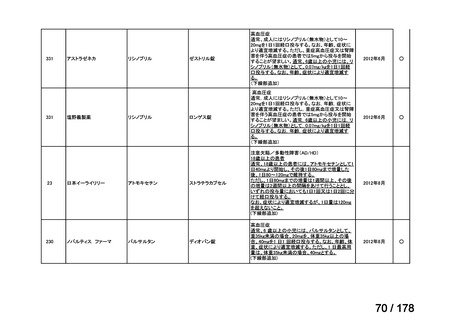
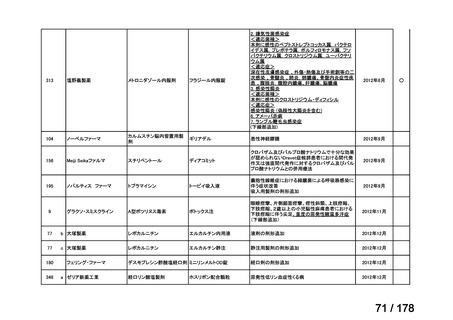
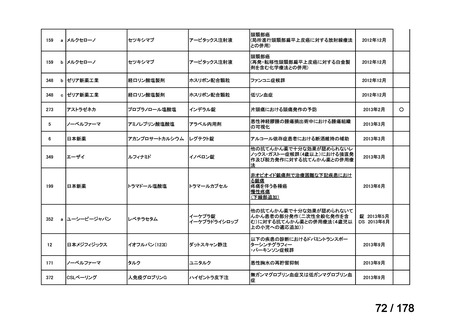
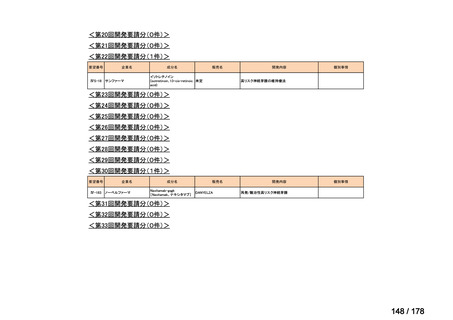
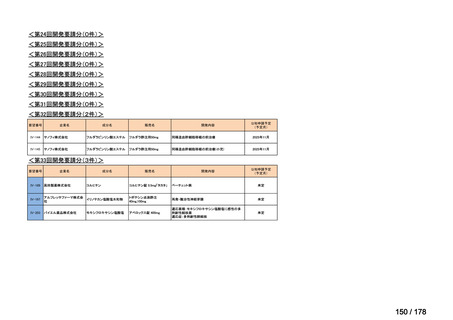
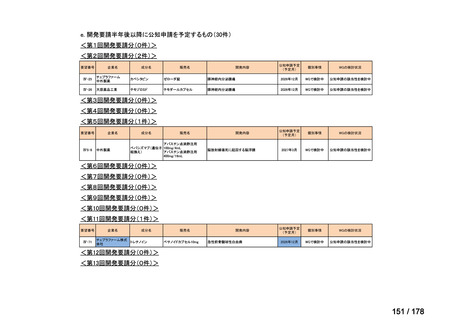
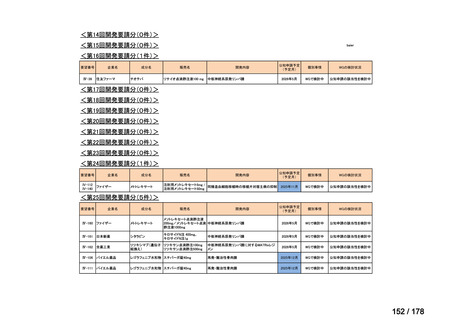
0
35
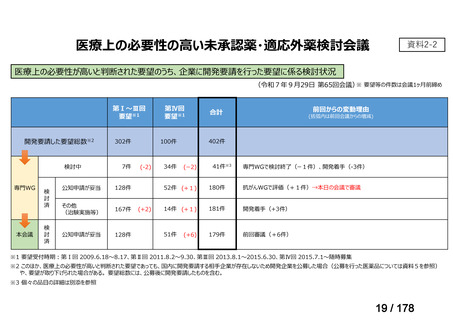
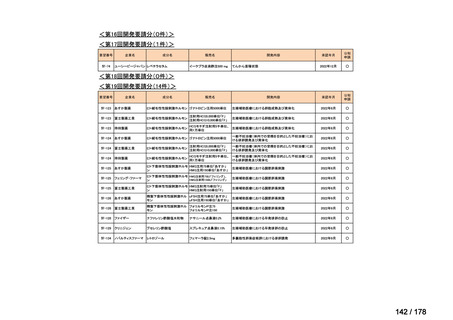
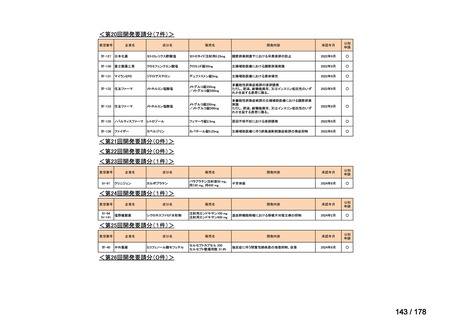
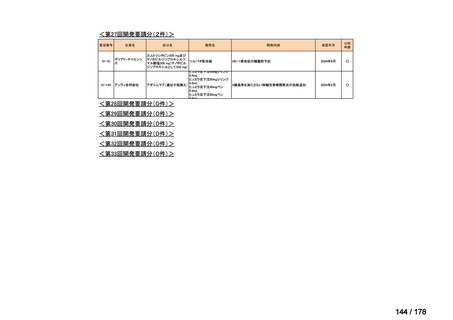
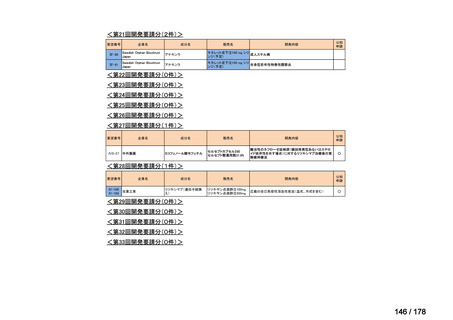
必要性高い
11
2
前回からの変動理由
グループC
開発の必要性が低い
グループD
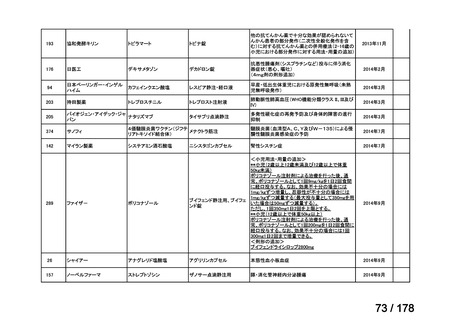
開発の必要性がない
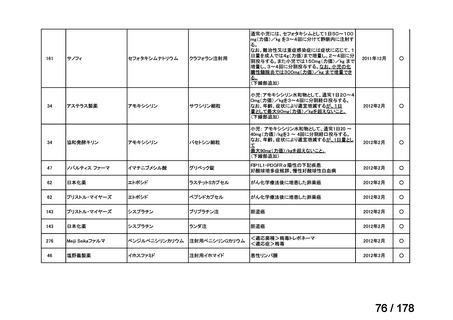
23
(括弧内は前回会議から
の増減)
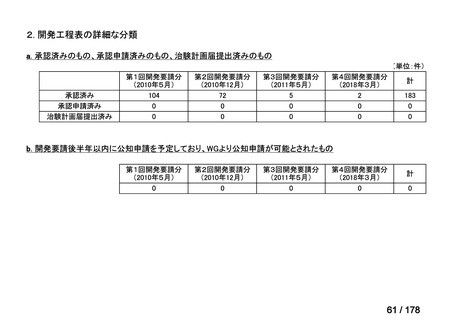
その他
開発中または
開発予定
8
2
1(+1)
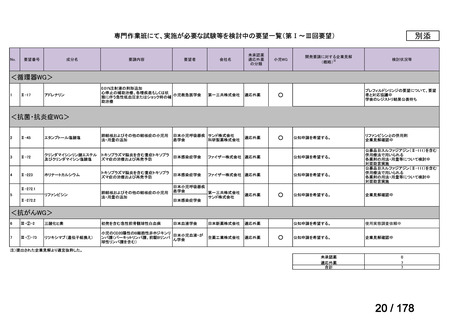
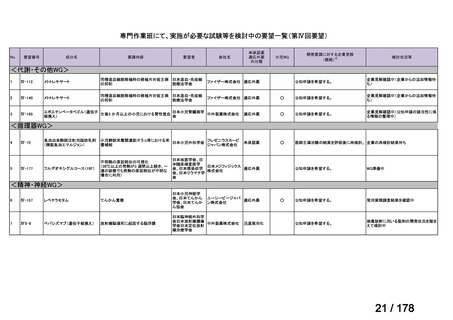
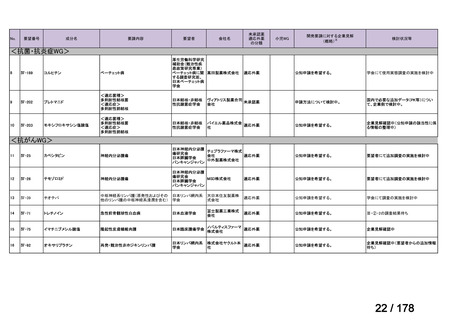
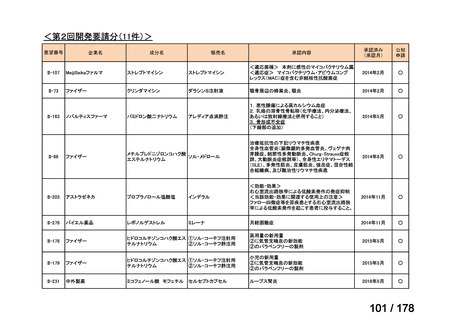
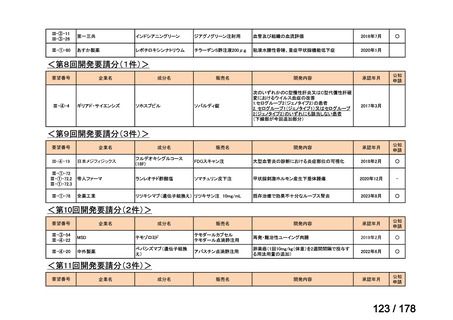
資料6のとおり
6
1(+1)
資料6のとおり
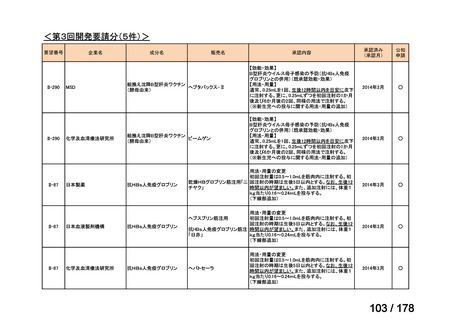
3
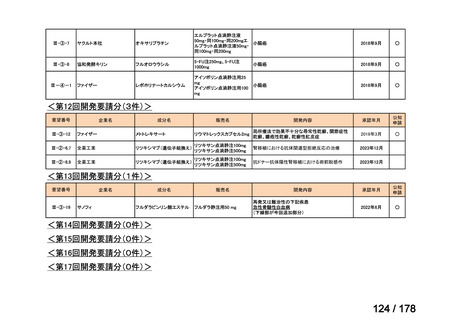
0
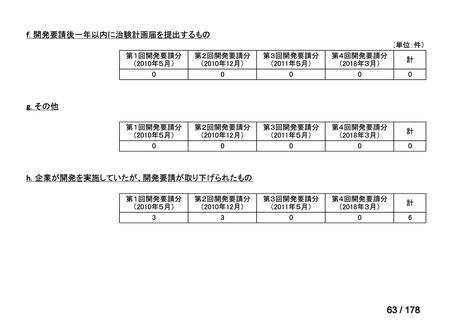
必要性高くない
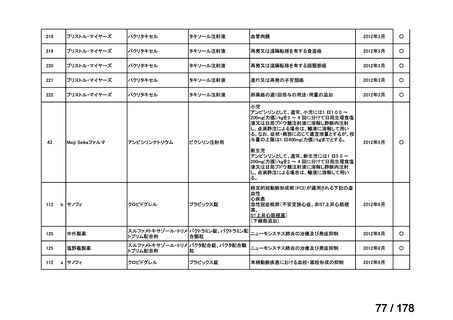
0
0
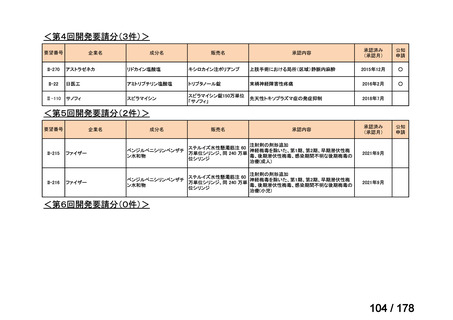
既に開発中
2
0
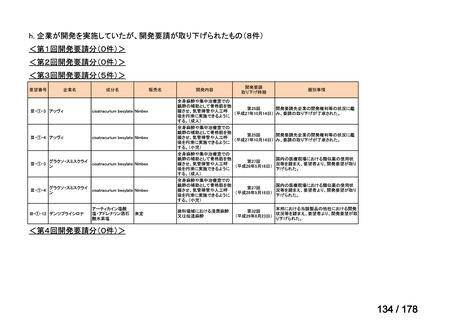
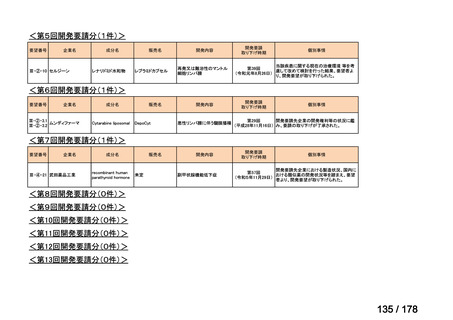
取り下げ等
1(+1)
4(+4)
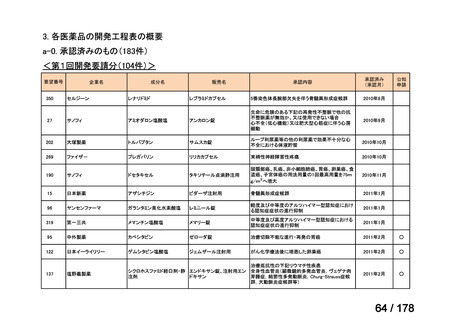
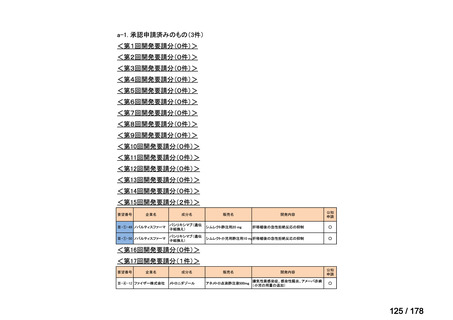
うち開発公募
うちその他
対象外
開発の必要性が
高い
41
うち開発要請
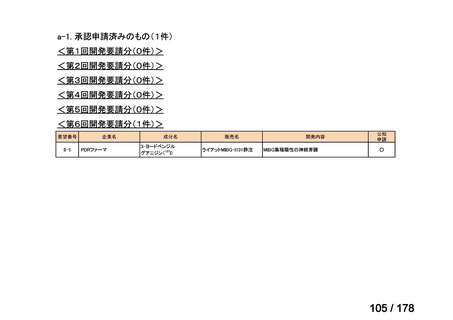
検討済
※3
グループB
14
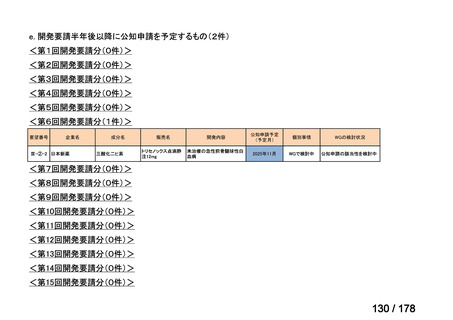
品目数
(令和7年9月29日 第65回会議)
86品目
グループA
※2
資料2-3
※4
※5
資料6のとおり
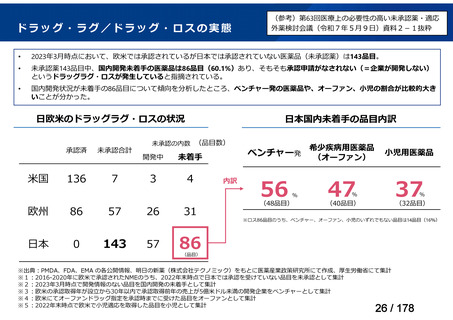
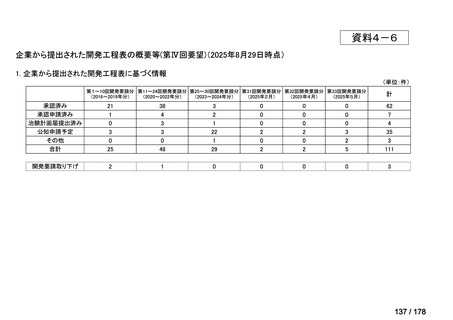
※1: 2016-2020年に欧米で承認されたNMEであって、2022年末時点で日本では承認を受けていない品目のうち、2023年3月時点で開発情報のない品目
(国内開発未着手品目)
出典:PMDA、FDA、EMA の各公開情報、明日の新薬(株式会社テクノミック)をもとに医薬産業政策研究所にて作成、厚生労働省にて集計
※2: 令和6年度厚生労働科学特別研究事業「ドラッグ・ロスの実態調査と解決手段の構築」による情報の整理結果。グループA「開発の必要性が特に
高い医薬品」、グループB「開発の必要性が高い医薬品」、グループC「開発の必要性が低い医薬品」、グループD「開発の必要性がない医薬品」、
その他「既にドラッグ・ロスが解消されている医薬品」 に分類。
※3: 既に学会や患者団体等から提出されていた要望、過去に検討会議で検討していた要望を含む
※4: 公募を行った医薬品については資料5を参照
※5: 類薬が開発中のため現時点、開発要請・開発公募をしていない品目
25 / 178