よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2/2時点
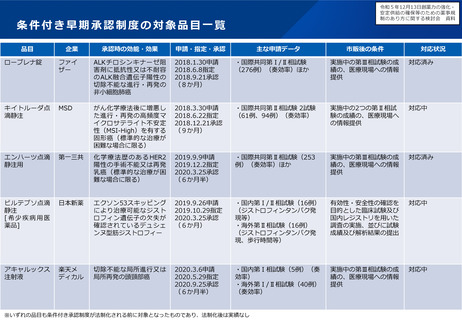
薬事検討会の検討状況
検討テーマ
検討状況
希少疾病用医薬品の指定のあり方について
令和5年7月10日検討会において、①いわゆる「輪切り」の要件に当たらない場合の明確化、②
医療上の必要性が認められる範囲の明確化、③指定時期を非臨床段階まで早期化することなどが
了承された。1月16日に改正通知を発出した。
小児用医薬品の開発促進に資する薬事審査等の
あり方について
令和5年7月10日検討会において、成人用の医薬品の開発時に、任意で、小児用の開発計画の策
定し、PMDAの確認を受けられる仕組みを導入することなどが了承された。令和6年1月12日に
関連通知を発出した。
開発促進
臨床試験
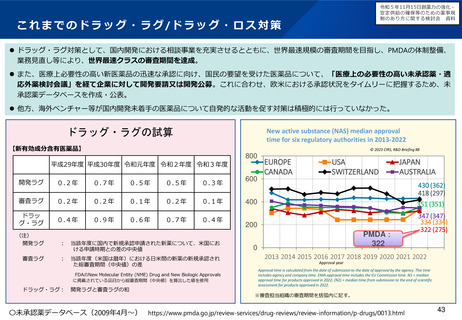
我が国の承認審査における日本人データの必要
性の整理について
治験の更なる効率化(エコシステム)について
市販後
安全対策
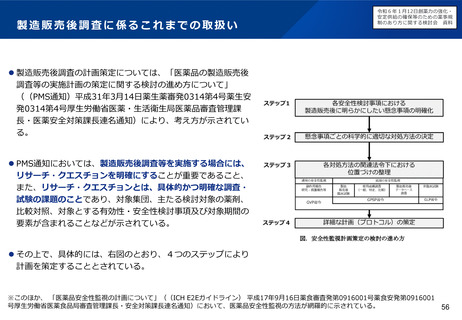
製造販売後に実施する使用成績調査等のあり方
について
リアルワールドデータの活用のあり方について
品質
医薬品の製造方法等に係る薬事審査等のあり方
について
情報発信
我が国の薬事制度に関する海外への情報発信に
ついて
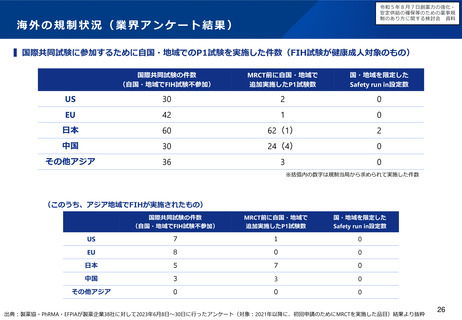
令和5年8月7日・9月13日検討会において、海外で臨床開発が先行した医薬品の国際共同治験
開始前の日本人での第Ⅰ相試験については、原則不要とすることが了承された。令和5年12月25
日に通知・QAを発出した。
令和5年12月13日検討会において、希少疾患等に用いる薬剤であって、外国においてのみ検証的
な臨床試験が実施されている場合における日本人データの必要性や、迅速な承認制度のあり方に
ついて議論を行った。引き続き検討会で議論を進める。
2~3月の検討会において議論予定。
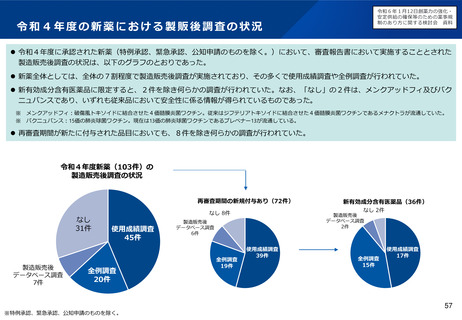
令和6年1月12日検討会において、製造販売後に実施する使用成績調査等のあり方や、その際の
リアルワールドデータの活用のあり方について議論を行った。引き続き検討会で議論を進める。
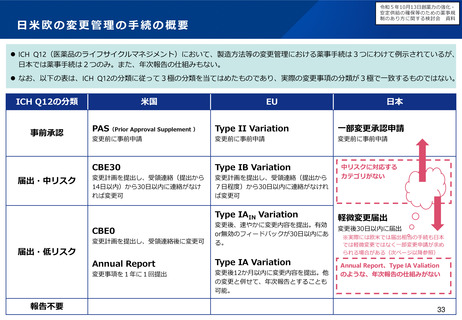
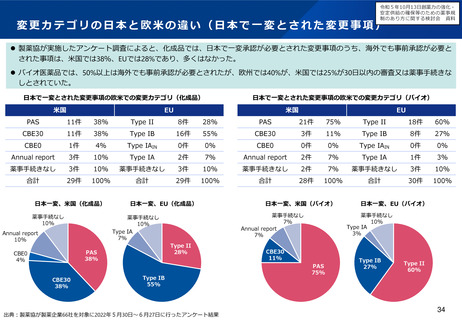
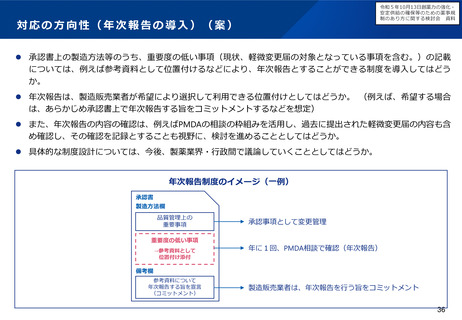
令和5年10月13日検討会において、欧米と同様に、中リスクの変更カテゴリや年次報告の仕組み
を試行的に導入することなどが了承された。具体的な運用について、現在検討中。
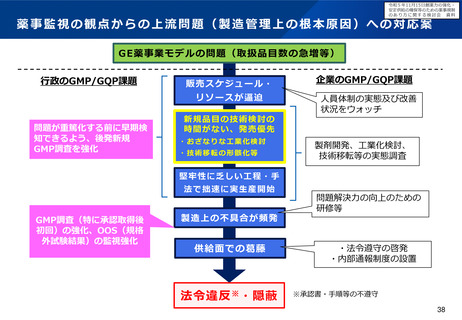
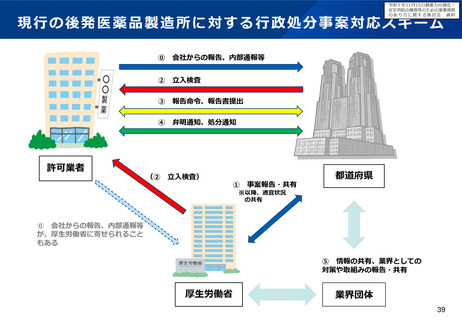
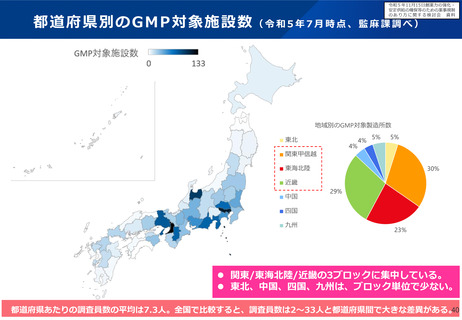
令和5年11月15日検討会において、医薬品製造業者等による不正事案への対応として、行政によ
る薬事監視について議論し立入調査・検査の強化の方向性について了承された。
令和5年11月15日検討会において、我が国の薬事制度についてPMDAの米国事務所の設置などを
通じて積極的・能動的に海外に情報発信していくことが重要であることなどが議論された。8
薬事検討会の検討状況
検討テーマ
検討状況
希少疾病用医薬品の指定のあり方について
令和5年7月10日検討会において、①いわゆる「輪切り」の要件に当たらない場合の明確化、②
医療上の必要性が認められる範囲の明確化、③指定時期を非臨床段階まで早期化することなどが
了承された。1月16日に改正通知を発出した。
小児用医薬品の開発促進に資する薬事審査等の
あり方について
令和5年7月10日検討会において、成人用の医薬品の開発時に、任意で、小児用の開発計画の策
定し、PMDAの確認を受けられる仕組みを導入することなどが了承された。令和6年1月12日に
関連通知を発出した。
開発促進
臨床試験
我が国の承認審査における日本人データの必要
性の整理について
治験の更なる効率化(エコシステム)について
市販後
安全対策
製造販売後に実施する使用成績調査等のあり方
について
リアルワールドデータの活用のあり方について
品質
医薬品の製造方法等に係る薬事審査等のあり方
について
情報発信
我が国の薬事制度に関する海外への情報発信に
ついて
令和5年8月7日・9月13日検討会において、海外で臨床開発が先行した医薬品の国際共同治験
開始前の日本人での第Ⅰ相試験については、原則不要とすることが了承された。令和5年12月25
日に通知・QAを発出した。
令和5年12月13日検討会において、希少疾患等に用いる薬剤であって、外国においてのみ検証的
な臨床試験が実施されている場合における日本人データの必要性や、迅速な承認制度のあり方に
ついて議論を行った。引き続き検討会で議論を進める。
2~3月の検討会において議論予定。
令和6年1月12日検討会において、製造販売後に実施する使用成績調査等のあり方や、その際の
リアルワールドデータの活用のあり方について議論を行った。引き続き検討会で議論を進める。
令和5年10月13日検討会において、欧米と同様に、中リスクの変更カテゴリや年次報告の仕組み
を試行的に導入することなどが了承された。具体的な運用について、現在検討中。
令和5年11月15日検討会において、医薬品製造業者等による不正事案への対応として、行政によ
る薬事監視について議論し立入調査・検査の強化の方向性について了承された。
令和5年11月15日検討会において、我が国の薬事制度についてPMDAの米国事務所の設置などを
通じて積極的・能動的に海外に情報発信していくことが重要であることなどが議論された。8