よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (32 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和5年10月13日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
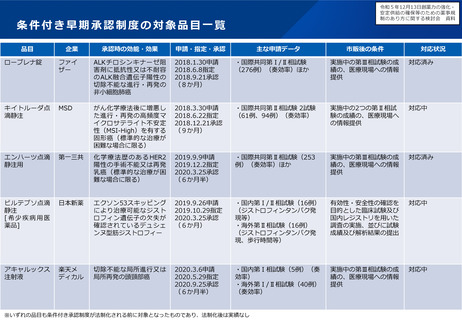
医薬品の変更管理の手続のあり方について(概要)
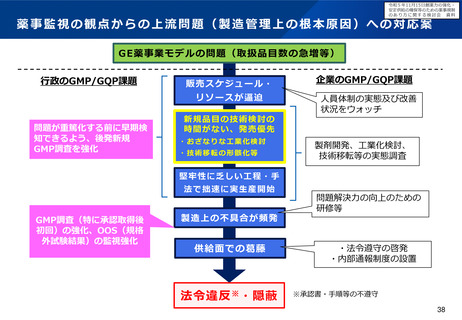
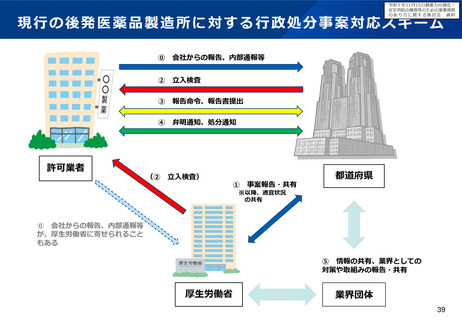
▍背景
• 医薬品の製造についてグローバル化が進み、特定の製造所において製造された製品が、世界各国に向けて出荷される
ことが通常となってきている。
• 医薬品の製造方法等は、堅牢で効率的な品質確保、安定供給等の観点から承認後も製造販売業者、製造業者により随
時見直しが行われるが、その変更内容に応じて、国・地域ごとの規制当局の審査等を受ける必要がある。
• このため、製造方法等の変更をしようとする場合は、全ての出荷先の規制当局に対する手続を完了する必要があるが、
欧米と比較して日本の変更手続は長期間を要することから、変更の承認が得るまでの間、日本向け製品の安定供給の
ための在庫確保等の負担となっているとの指摘を受けており、我が国における変更管理の手続のあり方について検討
したい。
※ なお、GMP調査は、企業・規制当局双方の負担が大きく、また、審査期間の短縮を妨げる要因になっているとの指摘があり、どの
ような場合に必要かなど別途検討を進めていく。
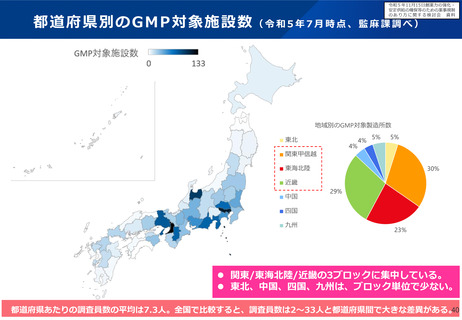
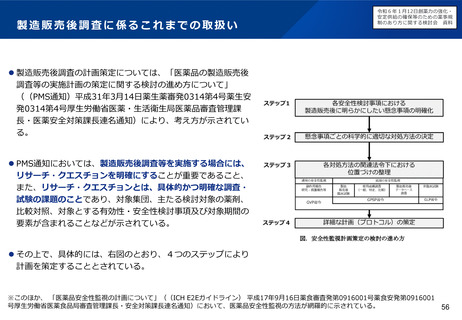
医薬品のグローバルでの製造の流れと変更管理のイメージ
日本向けに包装・出荷
製造所A
(製造工程①)
製造所B
(製造工程②)
製造所C
(製造工程③)
欧州向けに包装・出荷
製造方法等を
変更する場合
・全ての規制当局の手続完了待ち、
・手続の遅い国向けに旧製品の出荷継続
米国向けに包装・出荷
が必要
32
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
医薬品の変更管理の手続のあり方について(概要)
▍背景
• 医薬品の製造についてグローバル化が進み、特定の製造所において製造された製品が、世界各国に向けて出荷される
ことが通常となってきている。
• 医薬品の製造方法等は、堅牢で効率的な品質確保、安定供給等の観点から承認後も製造販売業者、製造業者により随
時見直しが行われるが、その変更内容に応じて、国・地域ごとの規制当局の審査等を受ける必要がある。
• このため、製造方法等の変更をしようとする場合は、全ての出荷先の規制当局に対する手続を完了する必要があるが、
欧米と比較して日本の変更手続は長期間を要することから、変更の承認が得るまでの間、日本向け製品の安定供給の
ための在庫確保等の負担となっているとの指摘を受けており、我が国における変更管理の手続のあり方について検討
したい。
※ なお、GMP調査は、企業・規制当局双方の負担が大きく、また、審査期間の短縮を妨げる要因になっているとの指摘があり、どの
ような場合に必要かなど別途検討を進めていく。
医薬品のグローバルでの製造の流れと変更管理のイメージ
日本向けに包装・出荷
製造所A
(製造工程①)
製造所B
(製造工程②)
製造所C
(製造工程③)
欧州向けに包装・出荷
製造方法等を
変更する場合
・全ての規制当局の手続完了待ち、
・手続の遅い国向けに旧製品の出荷継続
米国向けに包装・出荷
が必要
32