よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
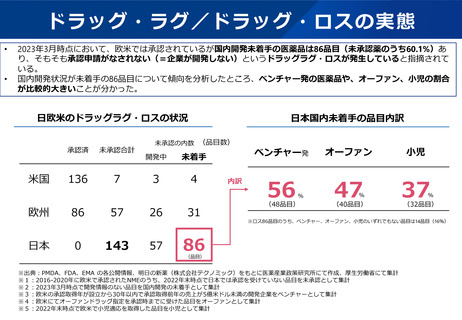
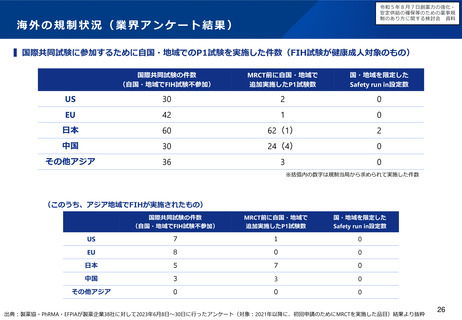
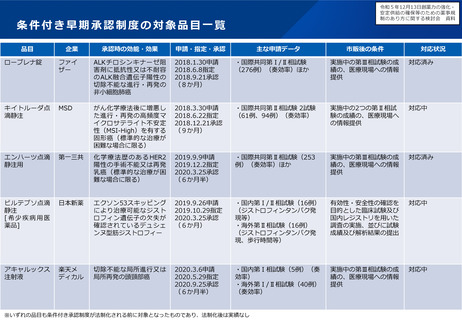
指定の早期化と取り消し要件の明確化
主な課題
令和5年7月10日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
対応の方向性(案)
▍指定の早期化
▍「計画が妥当であること」の不明瞭さ
• 「その開発に係る計画が妥当であると認
められること」の範囲が不明瞭であるた
め、次のような開発段階であることを求
められる場合がある。
✓ 第Ⅱ相試験が完了し、第Ⅲ相試験の
計画がPMDAと合意していなければ
ならない
✓ 第Ⅲ相試験の結果が得られなければ
ならない
>
• 薬機法第77条の2の指定対象の要件においては、開発の可能性に
ついては必ずしも明示されていないことも踏まえ、開発の可能性
については、国内での開発を行うことのできる体制及び計画を有
しているかどうかを確認することとしてはどうか。
• 具体的には、承認申請に至るまでに実施する予定の臨床試験(プ
ロトコールは不要であり、試験計画の概観が把握できればよい)
を示すとともに、少なくとも第1相試験を実施するために必要な
非臨床試験については概ね完了している程度の段階であれば、要
件を満たす場合があるのではないか。
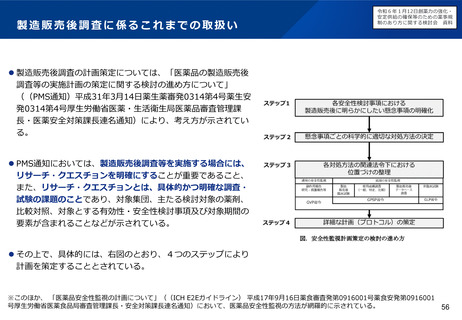
▍取り消し要件の明確化
• 指定の早期化に伴い、開発の進捗に伴い指定要件を満たさなく
なった場合には、指定取り消しとなる取扱を明確化してはどうか。
• しかしながら、特にベンチャー企業では、
希少疾病用医薬品に指定されていること
• 具体的には、次のような場合であって、指定要件を満たさなくな
をもって、投資を呼び込み、日本の臨床
ると考えられる場合に、取り消しを行うことが想定される。
開発に着手可能となる場合があるため、 >
✓ 臨床的位置付けが同様で、代替薬となり得る医薬品が承認さ
臨床開発の後期にならなければ指定を受
れた場合
けられない場合、日本への開発を断念す
✓ 臨床試験で達成基準を満たさなかった場合
る場合がある。
✓ 安全性を根拠に指定された場合であって、開発の進展に伴い
指定の根拠とした安全性上の優位性を確保できなくなった場
合
16
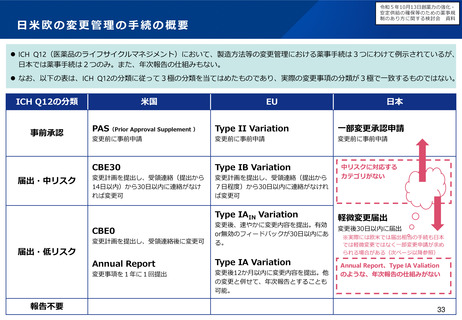
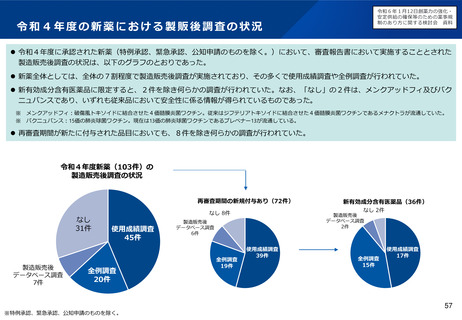
主な課題
令和5年7月10日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
対応の方向性(案)
▍指定の早期化
▍「計画が妥当であること」の不明瞭さ
• 「その開発に係る計画が妥当であると認
められること」の範囲が不明瞭であるた
め、次のような開発段階であることを求
められる場合がある。
✓ 第Ⅱ相試験が完了し、第Ⅲ相試験の
計画がPMDAと合意していなければ
ならない
✓ 第Ⅲ相試験の結果が得られなければ
ならない
>
• 薬機法第77条の2の指定対象の要件においては、開発の可能性に
ついては必ずしも明示されていないことも踏まえ、開発の可能性
については、国内での開発を行うことのできる体制及び計画を有
しているかどうかを確認することとしてはどうか。
• 具体的には、承認申請に至るまでに実施する予定の臨床試験(プ
ロトコールは不要であり、試験計画の概観が把握できればよい)
を示すとともに、少なくとも第1相試験を実施するために必要な
非臨床試験については概ね完了している程度の段階であれば、要
件を満たす場合があるのではないか。
▍取り消し要件の明確化
• 指定の早期化に伴い、開発の進捗に伴い指定要件を満たさなく
なった場合には、指定取り消しとなる取扱を明確化してはどうか。
• しかしながら、特にベンチャー企業では、
希少疾病用医薬品に指定されていること
• 具体的には、次のような場合であって、指定要件を満たさなくな
をもって、投資を呼び込み、日本の臨床
ると考えられる場合に、取り消しを行うことが想定される。
開発に着手可能となる場合があるため、 >
✓ 臨床的位置付けが同様で、代替薬となり得る医薬品が承認さ
臨床開発の後期にならなければ指定を受
れた場合
けられない場合、日本への開発を断念す
✓ 臨床試験で達成基準を満たさなかった場合
る場合がある。
✓ 安全性を根拠に指定された場合であって、開発の進展に伴い
指定の根拠とした安全性上の優位性を確保できなくなった場
合
16