よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (49 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和5年12月13日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
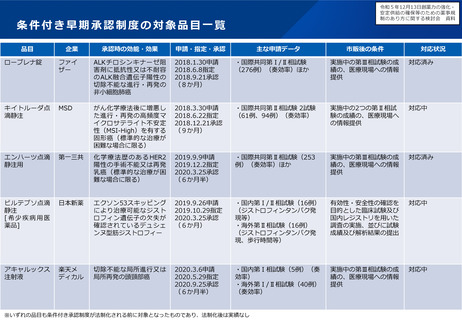
論点
⚫
⚫
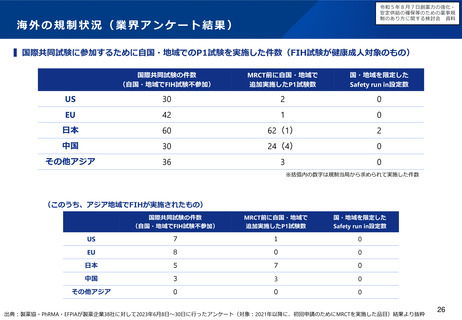
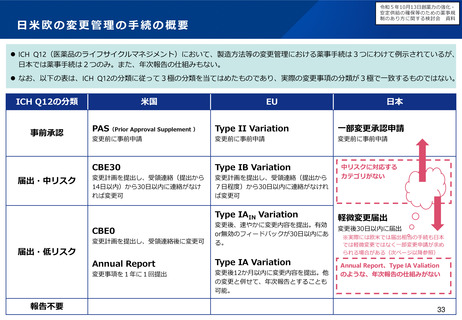
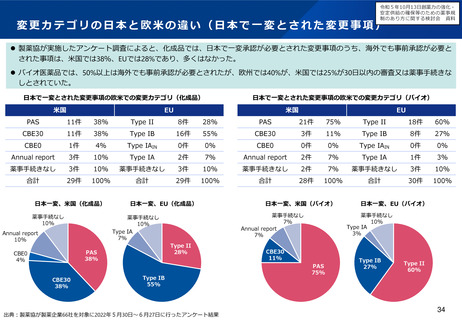
例えば、超希少疾患に用いる医薬品について、海外で検証的試験が実施済の場合、追加で実施する国内試験のフィージビリティ
を考慮し、海外試験との類似性を十分に評価することが難しいと考えらえる場合に、日本人患者に対する国内試験を実施する意
味について、どう考えるか。
•
治験の実施は、患者の医薬品への早期アクセスを確保する観点や、医療現場への情報提供の観点から、症例数が限定的であっ
ても実施することが重要と考えられるか(評価指標によっては、数例でも一定精度の評価は可能)。その場合、治験(拡大治
験を含む。)は実施するものの、必ずしもその完了を待たずに、中間的な結果に基づいて承認審査を行っていくことについて、
どう考えるか。
•
その際、条件付き承認制度を活用することについて、どう考えるか。
例えば、超希少疾患に用いる医薬品について、国際共同治験に日本が参加する場合のフィージビリティを考慮し、日本が国際共
同治験に参加する意味について、どう考えるか(なお、少数しか日本人が参加できない場合であっても、全体集団との一貫性を
科学的に評価することはできるとする考え方もある(次ページ参照))。
•
上記と同様に、患者アクセスや医療現場への情報提供、個別患者の評価の観点から、症例数が限定的であっても日本が国際共
同治験に参加することが重要と考えられるか。
⚫
これらの論点について、超希少疾患以外の場合にも同様と考えられるかどうかについて、どう考えるか。
⚫
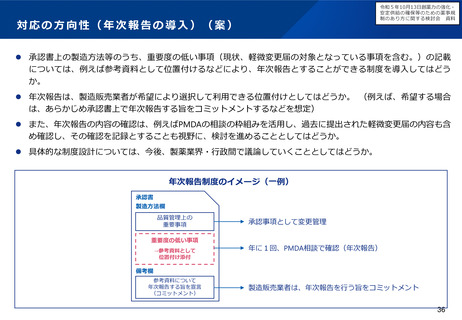
製造販売後に行うべき検討について、全例調査とする必要性を含め、どう考えるか(日本人症例に対する情報が相当限定される
可能性について)。
⚫
これらの論点について、日本における治験の空洞化を防ぎ、創薬力向上を図る観点からは、どう考えるか。
49
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
論点
⚫
⚫
例えば、超希少疾患に用いる医薬品について、海外で検証的試験が実施済の場合、追加で実施する国内試験のフィージビリティ
を考慮し、海外試験との類似性を十分に評価することが難しいと考えらえる場合に、日本人患者に対する国内試験を実施する意
味について、どう考えるか。
•
治験の実施は、患者の医薬品への早期アクセスを確保する観点や、医療現場への情報提供の観点から、症例数が限定的であっ
ても実施することが重要と考えられるか(評価指標によっては、数例でも一定精度の評価は可能)。その場合、治験(拡大治
験を含む。)は実施するものの、必ずしもその完了を待たずに、中間的な結果に基づいて承認審査を行っていくことについて、
どう考えるか。
•
その際、条件付き承認制度を活用することについて、どう考えるか。
例えば、超希少疾患に用いる医薬品について、国際共同治験に日本が参加する場合のフィージビリティを考慮し、日本が国際共
同治験に参加する意味について、どう考えるか(なお、少数しか日本人が参加できない場合であっても、全体集団との一貫性を
科学的に評価することはできるとする考え方もある(次ページ参照))。
•
上記と同様に、患者アクセスや医療現場への情報提供、個別患者の評価の観点から、症例数が限定的であっても日本が国際共
同治験に参加することが重要と考えられるか。
⚫
これらの論点について、超希少疾患以外の場合にも同様と考えられるかどうかについて、どう考えるか。
⚫
製造販売後に行うべき検討について、全例調査とする必要性を含め、どう考えるか(日本人症例に対する情報が相当限定される
可能性について)。
⚫
これらの論点について、日本における治験の空洞化を防ぎ、創薬力向上を図る観点からは、どう考えるか。
49