よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (15 ページ)
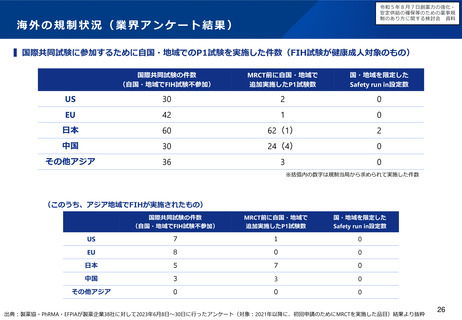
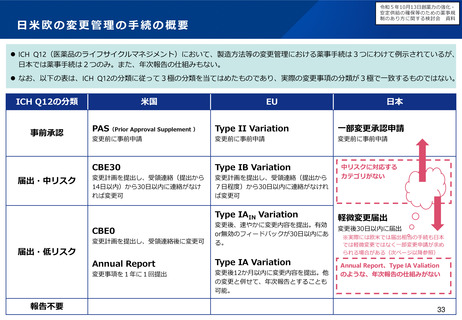
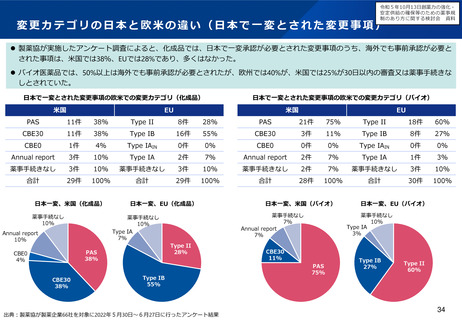
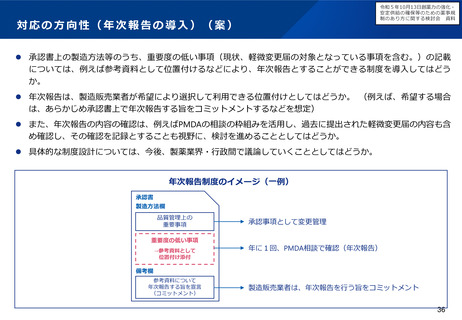
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和5年7月10日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
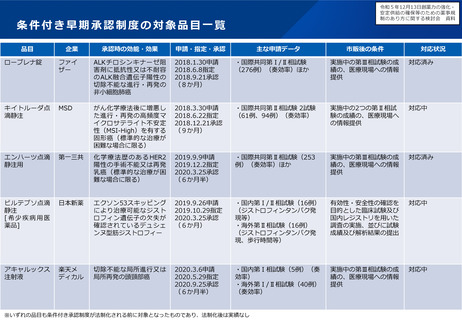
医療上の必要性の要件の明確化
主な課題
対応の方向性(案)
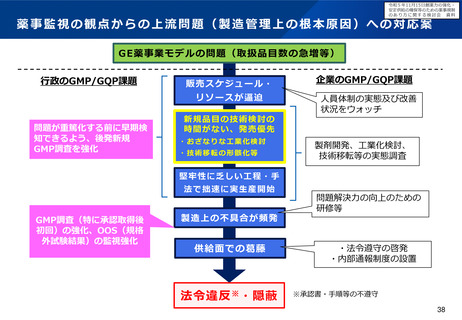
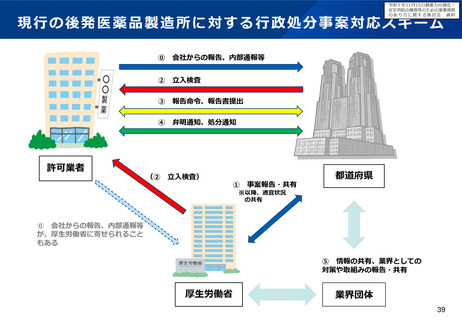
▍代替療法の考え方を例示・明確化
▍「代替する適切な」の不明瞭さ
• 「代替する適切な医薬品等又は治療方法がないこ
と」の範囲が不明瞭であるため、既承認薬があれば、
その効果の程度によらず代替する適切な医薬品があ >
ると判断される場合がある。
(例)
• 既承認薬が全くない場合のみではなく、既承認薬による治療
法がいずれも予後不良の場合など、充足性に応じて複数の治
療選択肢が必要とされている場合も要件に該当すると考えら
れるのではないか。
• 医療環境・投与環境から既承認薬の投与が困難である患者が
一定数存在すると考えられる場合も、要件に該当する場合が
あるのではないか。
• また、既承認薬による治療法の充足性が低い場合には、当該
疾患に対する新規作用機序であることや、非臨床データ等に
基づき有用性が期待できることをもって、要件に該当する場
合があるのではないか。また、必ずしも日本人のデータは必
要ないのではないか。
✓ 生命予後に重大な影響のある疾患であって、承認されている医薬
品では必ずしも十分に奏功が認められない場合であって、当該疾
患に対する新規作用機序の医薬品の開発を行おうとする場合
▍「著しく高い」の不明瞭さ
▍既存療法との比較の考え方を例示・明確化
• 「既存の医薬品等と比較して、著しく高い有効性又
は安全性」の範囲が不明瞭であるため、既承認薬と
直接比較した臨床試験の結果が求められる場合があ
る。
• 国際的に認められているガイドラインで治療選択肢の優先順
位が高く位置づけられている場合には、要件に該当する場合
があるのではないか。
(例)
✓ 海外のガイドラインにおいては国内既承認薬は第二選択、候補薬は第一
選択である場合も、それらを直接比較した臨床試験の結果が必要。
✓ 既承認薬はある特定の副作用に係る警告がなされており、候補薬の既承
認の効能ではそのような警告がない場合に、候補薬について適応追加し
ようとする場合も、著しく高い安全性があるとは認められない。
>
• 対照薬と直接比較した臨床試験の結果のみではなく、論文等
の異なる試験の結果から著しく高い有効性等が期待される場
合には、要件に該当する場合があるのではないか。
• 添付文書上の注意喚起の程度が明らかに異なる(例えば、既
承認の適応での警告欄における記載が異なる)場合や、安全
性プロファイルが明らかに異なる場合など、安全性において
優れている蓋然性が高い場合には、要件に該当する場合があ
るのではないか。
15
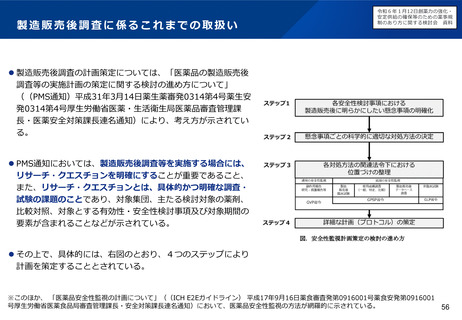
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
医療上の必要性の要件の明確化
主な課題
対応の方向性(案)
▍代替療法の考え方を例示・明確化
▍「代替する適切な」の不明瞭さ
• 「代替する適切な医薬品等又は治療方法がないこ
と」の範囲が不明瞭であるため、既承認薬があれば、
その効果の程度によらず代替する適切な医薬品があ >
ると判断される場合がある。
(例)
• 既承認薬が全くない場合のみではなく、既承認薬による治療
法がいずれも予後不良の場合など、充足性に応じて複数の治
療選択肢が必要とされている場合も要件に該当すると考えら
れるのではないか。
• 医療環境・投与環境から既承認薬の投与が困難である患者が
一定数存在すると考えられる場合も、要件に該当する場合が
あるのではないか。
• また、既承認薬による治療法の充足性が低い場合には、当該
疾患に対する新規作用機序であることや、非臨床データ等に
基づき有用性が期待できることをもって、要件に該当する場
合があるのではないか。また、必ずしも日本人のデータは必
要ないのではないか。
✓ 生命予後に重大な影響のある疾患であって、承認されている医薬
品では必ずしも十分に奏功が認められない場合であって、当該疾
患に対する新規作用機序の医薬品の開発を行おうとする場合
▍「著しく高い」の不明瞭さ
▍既存療法との比較の考え方を例示・明確化
• 「既存の医薬品等と比較して、著しく高い有効性又
は安全性」の範囲が不明瞭であるため、既承認薬と
直接比較した臨床試験の結果が求められる場合があ
る。
• 国際的に認められているガイドラインで治療選択肢の優先順
位が高く位置づけられている場合には、要件に該当する場合
があるのではないか。
(例)
✓ 海外のガイドラインにおいては国内既承認薬は第二選択、候補薬は第一
選択である場合も、それらを直接比較した臨床試験の結果が必要。
✓ 既承認薬はある特定の副作用に係る警告がなされており、候補薬の既承
認の効能ではそのような警告がない場合に、候補薬について適応追加し
ようとする場合も、著しく高い安全性があるとは認められない。
>
• 対照薬と直接比較した臨床試験の結果のみではなく、論文等
の異なる試験の結果から著しく高い有効性等が期待される場
合には、要件に該当する場合があるのではないか。
• 添付文書上の注意喚起の程度が明らかに異なる(例えば、既
承認の適応での警告欄における記載が異なる)場合や、安全
性プロファイルが明らかに異なる場合など、安全性において
優れている蓋然性が高い場合には、要件に該当する場合があ
るのではないか。
15