よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (59 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
製薬業界提出資料
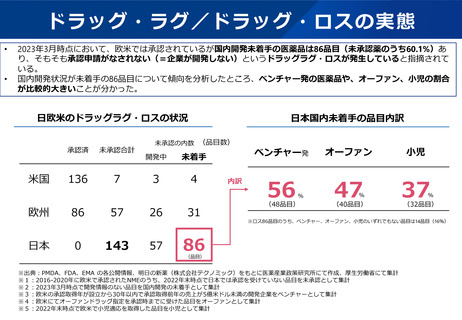
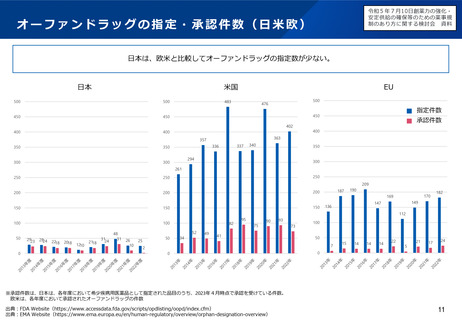
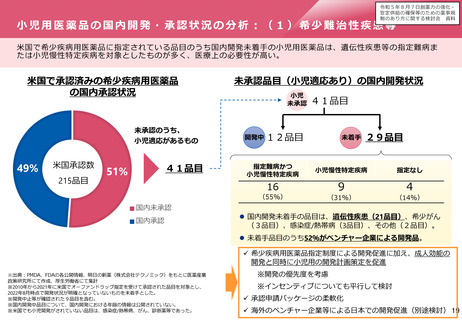
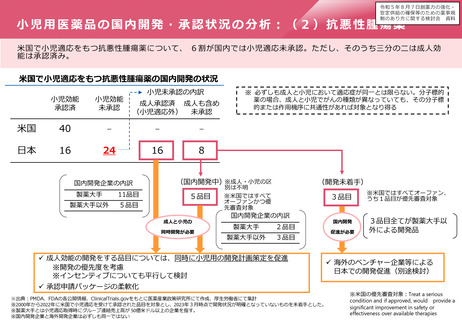
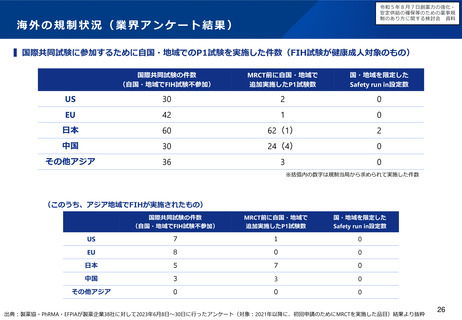
欧米との本邦での追加の安全性監視計画の比較
令和6年1月12日創薬力の強化・安定供給の確保等
のための薬事規制のあり方に関する検討会 資料
EUでの2019年の新規承認品目(後発品を・バイオシミラー除く)で米国及び日本でも承認されている品目から、
主な製造販売後調査・試験の内容を記載しカテゴリ毎に分類した。
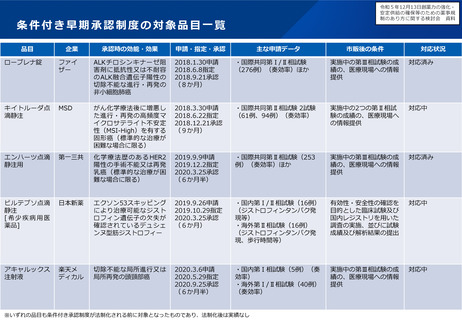
一般名
EMA RMP
FDA PMR/PMC
ベオビュ
なし
なし
セミプリマブ
なし
なし
Japan RMP
特定使用成績調査(眼内炎症,眼内炎,眼圧上昇,網膜色素上皮裂孔,網膜剥離及び網膜裂孔,網膜動脈
塞栓事象,眼以外の動脈血栓塞栓事象,網膜血管炎及び網膜血管閉塞)
特定使用成績調査 (Infusion reaction、大腸炎・重度の下痢、筋炎・横紋筋融解症・重症筋無力症、心筋炎・心膜炎、腎機能障
害(尿細管間質性腎炎等)、内分泌障害(甲状腺機能障害・副腎機能障害・下垂体機能障害)、1 型糖尿病、重度の皮膚障害、
神経障害(ギラン・バレー症候群等)、脳炎・髄膜炎、肝不全・肝機能障害・肝炎、間質性肺疾患、臓器移植歴(造血幹細胞移
植歴を含む)のある患者への使用、静脈血栓塞栓症、発熱性好中球減少症、免疫性血小板減少性紫斑病、膵炎、ぶどう膜炎)
ホスタマチニブ
ポラツズマブ
ベドチン
なし
なし
特定使用成績調査(全例調査)(長期投与時の安全性(重度の下痢、高血圧、肝機能障害、好中球減少、感染症)及び有効性)
Phase Ib/IIの2試験の完了データ提出
PIb/IIの2試験の完了データ提出
一般使用成績調査(全例調査)骨髄抑制,末梢性ニューロパチー,感染症,Infusion reaction,重要な潜在的リスク:進行性多
巣性白質脳症,腫瘍崩壊症候群,肝機能障害)
レレバクタム水和物/イミ なし
小児開発要請:単群試
5年間のサーベイランス
一般使用成績調査(全例調査)中枢神経症状、ショック、アナフィラキシー、中毒性表皮壊死融解症(Toxic Epidermal
ペネム水和物/シラスタチ
験とRCT
調査
Necrolysis: TEN)、皮膚粘膜眼症候群(Stevens-Johnson 症候群)、「重篤な肝障害」、「気管支痙攣、間質性肺炎、PIE
症候群」、「重篤な血液障害」、「重篤な腎障害」、「偽膜性大腸炎」及び「血栓性静脈炎」
ンナトリウム
ラブリズマブ
安全性評価(レジストリ活用) PIIIの完了データの提出
PIIIの完了データの提出
・日本人患者における有効性
特定使用成績調査(全例調査)(発作性夜間ヘモグロビン尿症,非典型溶血性尿毒症症候群,視神経脊髄炎スペクトラム障害の
オシロドロスタット
長期投与における安全性
PIIIの完了データの提出
再発予防)
特定使用成績調査(重要な特定されたリスク,重要な潜在的リス
PIIIの完了データの提出
ク,重要な不足情報に該当する事象)
ギルテリチニブ
専門医師への調査
アバトロンボパグ
特定集団での安全性評価(2試験)
PK試験
統合解析の提出
Invitro試験
一般使用成績調査(全例調査)(PRES、QT 間隔延長、心不全、心膜炎及び
小児での安全性・有効
非臨床試験
心嚢液貯留に加えて、骨髄抑制、感染症、出血、肝機能障害、腎障害、消化管穿孔、ILD
製造販売後データベース調査(血栓症/血栓塞栓症、重度の肝機能障害(Child-Pugh 分類及び過敏
C)患者における安全性、再投与時の
性評価試験
ロモソズマブ
安全性)
リスク最小化活動のアドヒアラ 2つの観察研究(重篤な CV評価の観察研究のためのフィージビリティ調
ンス評価
製造販売後データベース調査2つ(低カルシウム血症、腎機能障害患者)(重篤な心血管系事象、腎機能障害患者)
心疾患リスク,重篤な感 査
染症リスク)
リサンキズマブ
妊産婦のアウトカム評価
長期前向きコホート研究 妊産婦評価
比較観察研究
(アウトカ 製造販売後データベース調査(他の生物学的製剤との重篤な感染症発現率を比較)
ム:悪性腫瘍)
フレマネズマブ
妊産婦のアウトカム評価
長期投与における安全性 妊産婦のアウトカム評
小児のRCT試験
特定使用成績調査(心血管系事象,長期投与における安全性)
重篤なリスク評価(肺
小児開発要請:単群試験
特定使用成績調査(全例調査)(リンパ球数減少,感染症,投与
毒性)+妊産婦への曝
とRCT
開始時の徐脈性不整脈(伝導障害含む),QT 延長,黄斑浮腫,
価2試験
シポニモド
妊産婦のアウトカム評価/リス
長期継続試験
ク最小化活動評価
露評価
製造販売後臨床試験(長期投与における有効性)
血栓塞栓症,悪性腫瘍,可逆性後白質脳症症候群重要、他の疾患
修飾薬からの切替え後の安全性及び有効性)
ダコミチニブ
観察研究(使用実態/アウトカム)
ツロクトコグ アルファ ペ
長期安全性(レジストリ活用) 長期投与における安全性 PIII:長期安全性
PK試験
特定使用成績調査(間質性肺疾患のリスク要因の検討)
一般使用成績調査 (インヒビターの発生、 ショック、アナフィラキシー、不適切な試薬を用いた血液凝固第 VIII 因子活性測定に
起因する過量投与)
ゴル
ペグバリアーゼ
妊産婦の評価+安全性の観察研 炎症関連の検査値につい 妊産婦評価+観察研究
免疫寛容導入レジメンの
特定使用成績調査(アナフィラキシーを含む過敏症反応、低フェニルアラニン血症関節痛、注射部位反応、免疫複合体疾患等の
究
試験
免疫複合体介在性の終末器官障害、胚・胎児毒性、PEG を含有する注射剤と併用した際の過敏症反応の増加、重要な不足情報:
ての研究
(長期安安全性、免疫
介在反応)
ウパダシチニブ
ラロトレクチニブ
長期投与における安全性
小児開発要請:単群試験
察研究
性
とRCT
小児の臨床試験
PK 試験
安全性評価(レジストリ活用)
アンデキサネット アルファ 小児患者のPK試験
長期投与時の安全)
MACEの評価対照あり観 長期投与における安全
PIIIb/IV相試験(血栓症
P IV試験
特定使用成績調査(長期安全性、小児)
製造販売後データベース調査(悪性腫瘍,CV,重篤感染症)
特定使用成績調査(成人+小児)
小児の製造販売後臨床試験
特定使用成績調査(血栓性事象、Infusion reaction、再出血)
および血栓塞栓症リス
ク)
ロルラチニブ
有効性評価の臨床試験
追加の安全性監視がない
肝障害患者の臨床試験+ PK 試験
RCT試験の実施+PIII完
特定使用成績調査(中枢神経系障害,CYPIIIA 誘導剤との併用時
PIII完了データ提出
了データ提出
の安全性)
治験の最終結果の提出等
非臨床、薬物動態、その他の観察研究(部分集団/特定のアウトカム)
PIII完了データ提出
カテゴリー分類
介入なし:観察研究を実施(単群)
介入なし:観察研究を実施(対照群あり)
介入あり:CT(単群)
介入あり:CT(対照群あり)
59
欧米との本邦での追加の安全性監視計画の比較
令和6年1月12日創薬力の強化・安定供給の確保等
のための薬事規制のあり方に関する検討会 資料
EUでの2019年の新規承認品目(後発品を・バイオシミラー除く)で米国及び日本でも承認されている品目から、
主な製造販売後調査・試験の内容を記載しカテゴリ毎に分類した。
一般名
EMA RMP
FDA PMR/PMC
ベオビュ
なし
なし
セミプリマブ
なし
なし
Japan RMP
特定使用成績調査(眼内炎症,眼内炎,眼圧上昇,網膜色素上皮裂孔,網膜剥離及び網膜裂孔,網膜動脈
塞栓事象,眼以外の動脈血栓塞栓事象,網膜血管炎及び網膜血管閉塞)
特定使用成績調査 (Infusion reaction、大腸炎・重度の下痢、筋炎・横紋筋融解症・重症筋無力症、心筋炎・心膜炎、腎機能障
害(尿細管間質性腎炎等)、内分泌障害(甲状腺機能障害・副腎機能障害・下垂体機能障害)、1 型糖尿病、重度の皮膚障害、
神経障害(ギラン・バレー症候群等)、脳炎・髄膜炎、肝不全・肝機能障害・肝炎、間質性肺疾患、臓器移植歴(造血幹細胞移
植歴を含む)のある患者への使用、静脈血栓塞栓症、発熱性好中球減少症、免疫性血小板減少性紫斑病、膵炎、ぶどう膜炎)
ホスタマチニブ
ポラツズマブ
ベドチン
なし
なし
特定使用成績調査(全例調査)(長期投与時の安全性(重度の下痢、高血圧、肝機能障害、好中球減少、感染症)及び有効性)
Phase Ib/IIの2試験の完了データ提出
PIb/IIの2試験の完了データ提出
一般使用成績調査(全例調査)骨髄抑制,末梢性ニューロパチー,感染症,Infusion reaction,重要な潜在的リスク:進行性多
巣性白質脳症,腫瘍崩壊症候群,肝機能障害)
レレバクタム水和物/イミ なし
小児開発要請:単群試
5年間のサーベイランス
一般使用成績調査(全例調査)中枢神経症状、ショック、アナフィラキシー、中毒性表皮壊死融解症(Toxic Epidermal
ペネム水和物/シラスタチ
験とRCT
調査
Necrolysis: TEN)、皮膚粘膜眼症候群(Stevens-Johnson 症候群)、「重篤な肝障害」、「気管支痙攣、間質性肺炎、PIE
症候群」、「重篤な血液障害」、「重篤な腎障害」、「偽膜性大腸炎」及び「血栓性静脈炎」
ンナトリウム
ラブリズマブ
安全性評価(レジストリ活用) PIIIの完了データの提出
PIIIの完了データの提出
・日本人患者における有効性
特定使用成績調査(全例調査)(発作性夜間ヘモグロビン尿症,非典型溶血性尿毒症症候群,視神経脊髄炎スペクトラム障害の
オシロドロスタット
長期投与における安全性
PIIIの完了データの提出
再発予防)
特定使用成績調査(重要な特定されたリスク,重要な潜在的リス
PIIIの完了データの提出
ク,重要な不足情報に該当する事象)
ギルテリチニブ
専門医師への調査
アバトロンボパグ
特定集団での安全性評価(2試験)
PK試験
統合解析の提出
Invitro試験
一般使用成績調査(全例調査)(PRES、QT 間隔延長、心不全、心膜炎及び
小児での安全性・有効
非臨床試験
心嚢液貯留に加えて、骨髄抑制、感染症、出血、肝機能障害、腎障害、消化管穿孔、ILD
製造販売後データベース調査(血栓症/血栓塞栓症、重度の肝機能障害(Child-Pugh 分類及び過敏
C)患者における安全性、再投与時の
性評価試験
ロモソズマブ
安全性)
リスク最小化活動のアドヒアラ 2つの観察研究(重篤な CV評価の観察研究のためのフィージビリティ調
ンス評価
製造販売後データベース調査2つ(低カルシウム血症、腎機能障害患者)(重篤な心血管系事象、腎機能障害患者)
心疾患リスク,重篤な感 査
染症リスク)
リサンキズマブ
妊産婦のアウトカム評価
長期前向きコホート研究 妊産婦評価
比較観察研究
(アウトカ 製造販売後データベース調査(他の生物学的製剤との重篤な感染症発現率を比較)
ム:悪性腫瘍)
フレマネズマブ
妊産婦のアウトカム評価
長期投与における安全性 妊産婦のアウトカム評
小児のRCT試験
特定使用成績調査(心血管系事象,長期投与における安全性)
重篤なリスク評価(肺
小児開発要請:単群試験
特定使用成績調査(全例調査)(リンパ球数減少,感染症,投与
毒性)+妊産婦への曝
とRCT
開始時の徐脈性不整脈(伝導障害含む),QT 延長,黄斑浮腫,
価2試験
シポニモド
妊産婦のアウトカム評価/リス
長期継続試験
ク最小化活動評価
露評価
製造販売後臨床試験(長期投与における有効性)
血栓塞栓症,悪性腫瘍,可逆性後白質脳症症候群重要、他の疾患
修飾薬からの切替え後の安全性及び有効性)
ダコミチニブ
観察研究(使用実態/アウトカム)
ツロクトコグ アルファ ペ
長期安全性(レジストリ活用) 長期投与における安全性 PIII:長期安全性
PK試験
特定使用成績調査(間質性肺疾患のリスク要因の検討)
一般使用成績調査 (インヒビターの発生、 ショック、アナフィラキシー、不適切な試薬を用いた血液凝固第 VIII 因子活性測定に
起因する過量投与)
ゴル
ペグバリアーゼ
妊産婦の評価+安全性の観察研 炎症関連の検査値につい 妊産婦評価+観察研究
免疫寛容導入レジメンの
特定使用成績調査(アナフィラキシーを含む過敏症反応、低フェニルアラニン血症関節痛、注射部位反応、免疫複合体疾患等の
究
試験
免疫複合体介在性の終末器官障害、胚・胎児毒性、PEG を含有する注射剤と併用した際の過敏症反応の増加、重要な不足情報:
ての研究
(長期安安全性、免疫
介在反応)
ウパダシチニブ
ラロトレクチニブ
長期投与における安全性
小児開発要請:単群試験
察研究
性
とRCT
小児の臨床試験
PK 試験
安全性評価(レジストリ活用)
アンデキサネット アルファ 小児患者のPK試験
長期投与時の安全)
MACEの評価対照あり観 長期投与における安全
PIIIb/IV相試験(血栓症
P IV試験
特定使用成績調査(長期安全性、小児)
製造販売後データベース調査(悪性腫瘍,CV,重篤感染症)
特定使用成績調査(成人+小児)
小児の製造販売後臨床試験
特定使用成績調査(血栓性事象、Infusion reaction、再出血)
および血栓塞栓症リス
ク)
ロルラチニブ
有効性評価の臨床試験
追加の安全性監視がない
肝障害患者の臨床試験+ PK 試験
RCT試験の実施+PIII完
特定使用成績調査(中枢神経系障害,CYPIIIA 誘導剤との併用時
PIII完了データ提出
了データ提出
の安全性)
治験の最終結果の提出等
非臨床、薬物動態、その他の観察研究(部分集団/特定のアウトカム)
PIII完了データ提出
カテゴリー分類
介入なし:観察研究を実施(単群)
介入なし:観察研究を実施(対照群あり)
介入あり:CT(単群)
介入あり:CT(対照群あり)
59