よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (55 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
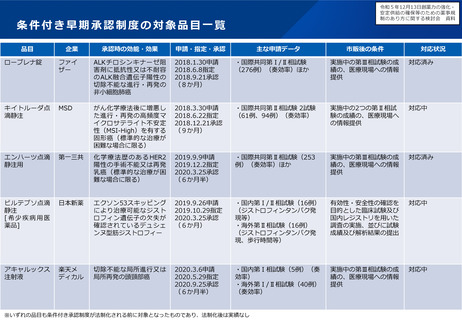
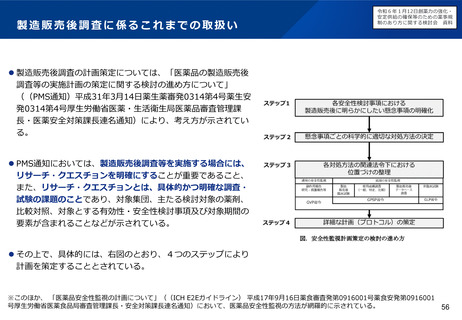
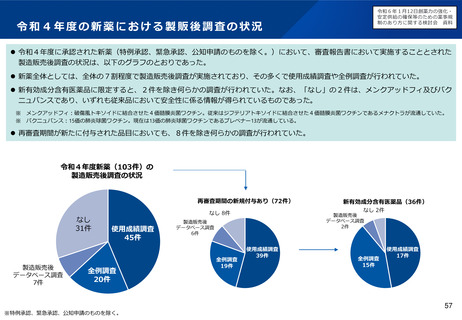
製造販売後に実施する使用成績調査等のあり方について及びリアルワールド
令和6年1月12日創薬力の強化・
データの活用のあり方について(概要)
安定供給の確保等のための薬事規
制のあり方に関する検討会
▍背景
➢
➢
新薬の承認審査においては、承認申請時までに得られた治験等の情報には限り
があり、製造販売後の当該医薬品の使用患者層の広がり(高齢者等)や、類薬
で知られている副作用の発現等、継続的な情報収集が必要な場合が多い。
これらの情報収集については、承認条件として医薬品リスク管理計画の策定が
義務づけられた上で、追加の安全性監視活動として調査が計画・実施され、再
審査時に当該調査結果を含めた再審査申請資料の審査の結果、RMPの策定・実
施に係る承認条件が解除される場合が多い。
➢
追加の安全性監視の方法としては、市販直後調査(自発報告の収集強化)に加
えて、使用成績調査(全例調査を含む)、製造販売後データベース調査、製造
販売後臨床試験などがあるが、従来、我が国で承認される新薬においては、使
用成績調査が中心に実施されてきた。
➢
これらの調査については、
•
再審査のために本来必要のない使用成績調査が課されているのではないか
•
使用成績調査について、海外では日本ほど多く活用されておらず、製薬企
業や医療機関にとっての負担が大きいのではないか
•
全例調査について、医療機関にとっての負担が大きい一方で、有効性や安
全性に係る迅速な情報の収集に資するものになっていないのではないか
•
製造販売後データベース調査の利用を促進すべきではないか
等の課題を指摘されている。
➢
このため、使用成績調査を含めた製造販売後の追加の安全性管理のあり方を検
討し、それぞれの医薬品の特徴に根ざした合理的な調査計画の策定が可能とな
る方策について検討したい。
製造販売後に実施する安全性監視活動の例
⚫ 副作用情報の自発報告
⚫ 使用成績調査(全例調査含む。)
⚫ データベース調査
⚫ 臨床試験
• 再審査のために本来必要のない使用成
績調査が課されているのでは
• 海外では日本ほど多く活用されておら
ず、製薬企業や医療機関の負担大
• 全例調査は、医療機関の負担大。一方、
迅速な情報収集にも資さないのでは
• DB調査の利用を促進すべき
といった課題が指摘されている
55
資料
令和6年1月12日創薬力の強化・
データの活用のあり方について(概要)
安定供給の確保等のための薬事規
制のあり方に関する検討会
▍背景
➢
➢
新薬の承認審査においては、承認申請時までに得られた治験等の情報には限り
があり、製造販売後の当該医薬品の使用患者層の広がり(高齢者等)や、類薬
で知られている副作用の発現等、継続的な情報収集が必要な場合が多い。
これらの情報収集については、承認条件として医薬品リスク管理計画の策定が
義務づけられた上で、追加の安全性監視活動として調査が計画・実施され、再
審査時に当該調査結果を含めた再審査申請資料の審査の結果、RMPの策定・実
施に係る承認条件が解除される場合が多い。
➢
追加の安全性監視の方法としては、市販直後調査(自発報告の収集強化)に加
えて、使用成績調査(全例調査を含む)、製造販売後データベース調査、製造
販売後臨床試験などがあるが、従来、我が国で承認される新薬においては、使
用成績調査が中心に実施されてきた。
➢
これらの調査については、
•
再審査のために本来必要のない使用成績調査が課されているのではないか
•
使用成績調査について、海外では日本ほど多く活用されておらず、製薬企
業や医療機関にとっての負担が大きいのではないか
•
全例調査について、医療機関にとっての負担が大きい一方で、有効性や安
全性に係る迅速な情報の収集に資するものになっていないのではないか
•
製造販売後データベース調査の利用を促進すべきではないか
等の課題を指摘されている。
➢
このため、使用成績調査を含めた製造販売後の追加の安全性管理のあり方を検
討し、それぞれの医薬品の特徴に根ざした合理的な調査計画の策定が可能とな
る方策について検討したい。
製造販売後に実施する安全性監視活動の例
⚫ 副作用情報の自発報告
⚫ 使用成績調査(全例調査含む。)
⚫ データベース調査
⚫ 臨床試験
• 再審査のために本来必要のない使用成
績調査が課されているのでは
• 海外では日本ほど多く活用されておら
ず、製薬企業や医療機関の負担大
• 全例調査は、医療機関の負担大。一方、
迅速な情報収集にも資さないのでは
• DB調査の利用を促進すべき
といった課題が指摘されている
55
資料