よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (45 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和5年11月15日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
医薬品国内開発伴走事業(バイオテック・コンシェルジュ事業の拡充)
令和6年度概算要求額
厚生労働省 令和6年度概算要求
66百万円(9百万円)※()内は前年度当初予算額
1 事業の目的
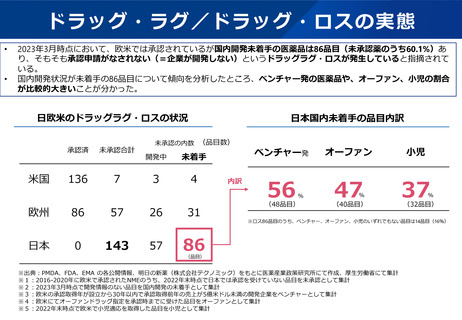
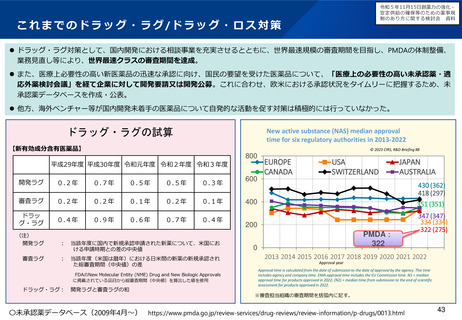
○ 近年、欧米では承認されている医薬品が日本で開発が行われ
ない、いわゆる「ドラッグ・ロス」の拡大が指摘されている。
この背景には、日本の創薬力や市場性の低下のほか、革新的新
薬のシーズを海外ベンチャーに依存するビジネスモデルへの転
換等の創薬環境の構造変化がある。
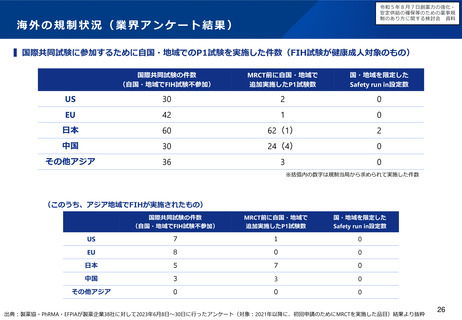
日本国内未着手の86品目内訳(2023年3月)
ベンチャー発
オーファン
小児
56
47
37
○ このため、国内での中小企業への支援に留まらず、新たに、
%
%
%
海外の中小バイオ企業による日本での開発・薬事申請を促すた
(48品目)
(40品目)
(32品目)
め、米国等において、英語で、日本の薬事制度の情報発信、薬
事の相談対応を無料で行う。特に、「未承認薬・適応外薬検討
※86品目のうち、ベンチャー、オーファン、小児のいずれでもない品目は14品目(16%)
会議」で開発公募された品目を重点的に対象とし、日本での治
験実施を含めた薬事相談に応じる
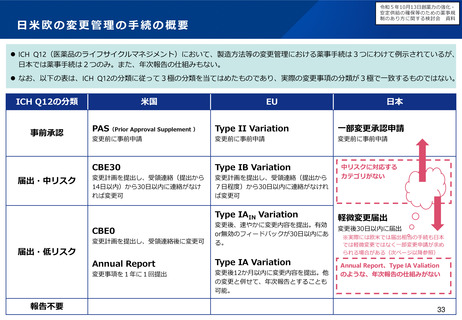
○ また、相談・支援の窓口となる拠点としてPMDA米国事務所を設置する(国際共同治験等で米国FDAとも連携)。
3 実施主体等
2 事業の概要・スキーム
現地(商談会、学会等)にて
✓ 日本の薬事制度の発信
✓ 日本での開発について無料相談
「未承認薬・適応外
薬検討会議」で開発
公募された品目等
英語資料のまま相談可能
(日本語への翻訳不要)
米国事務所
米国ベンチャー企業
日本で開発・薬事申請
日本で開発・承認
を目指したい
実施主体:PMDA
費用内訳:
(運営費交付金)
・人件費(伴走支援・広報):補助率100/
100
・旅費・滞在費(米国、欧州)
・翻訳・通訳費、相談ブース借料、広報費等
(補助金)
・PMDA米国事務所経費(家賃、人件費(現
地採用職員)等):補助率50/100
45
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
医薬品国内開発伴走事業(バイオテック・コンシェルジュ事業の拡充)
令和6年度概算要求額
厚生労働省 令和6年度概算要求
66百万円(9百万円)※()内は前年度当初予算額
1 事業の目的
○ 近年、欧米では承認されている医薬品が日本で開発が行われ
ない、いわゆる「ドラッグ・ロス」の拡大が指摘されている。
この背景には、日本の創薬力や市場性の低下のほか、革新的新
薬のシーズを海外ベンチャーに依存するビジネスモデルへの転
換等の創薬環境の構造変化がある。
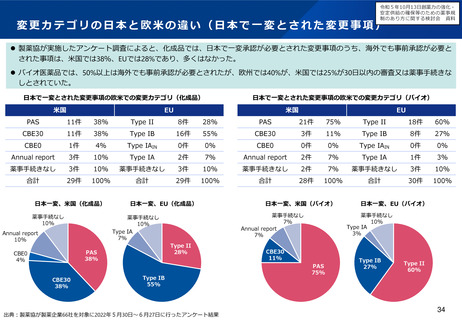
日本国内未着手の86品目内訳(2023年3月)
ベンチャー発
オーファン
小児
56
47
37
○ このため、国内での中小企業への支援に留まらず、新たに、
%
%
%
海外の中小バイオ企業による日本での開発・薬事申請を促すた
(48品目)
(40品目)
(32品目)
め、米国等において、英語で、日本の薬事制度の情報発信、薬
事の相談対応を無料で行う。特に、「未承認薬・適応外薬検討
※86品目のうち、ベンチャー、オーファン、小児のいずれでもない品目は14品目(16%)
会議」で開発公募された品目を重点的に対象とし、日本での治
験実施を含めた薬事相談に応じる
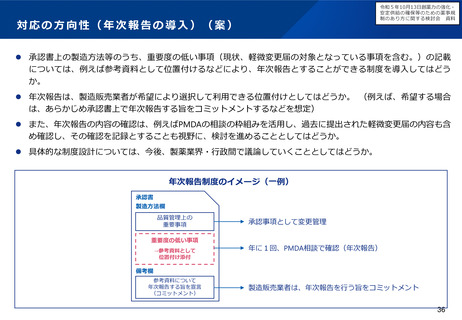
○ また、相談・支援の窓口となる拠点としてPMDA米国事務所を設置する(国際共同治験等で米国FDAとも連携)。
3 実施主体等
2 事業の概要・スキーム
現地(商談会、学会等)にて
✓ 日本の薬事制度の発信
✓ 日本での開発について無料相談
「未承認薬・適応外
薬検討会議」で開発
公募された品目等
英語資料のまま相談可能
(日本語への翻訳不要)
米国事務所
米国ベンチャー企業
日本で開発・薬事申請
日本で開発・承認
を目指したい
実施主体:PMDA
費用内訳:
(運営費交付金)
・人件費(伴走支援・広報):補助率100/
100
・旅費・滞在費(米国、欧州)
・翻訳・通訳費、相談ブース借料、広報費等
(補助金)
・PMDA米国事務所経費(家賃、人件費(現
地採用職員)等):補助率50/100
45