よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
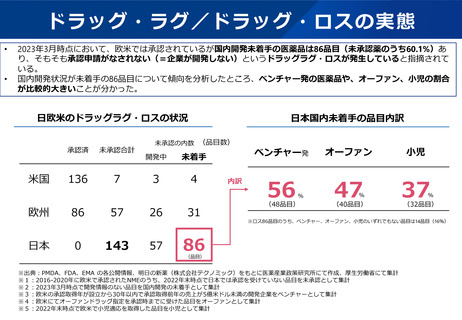
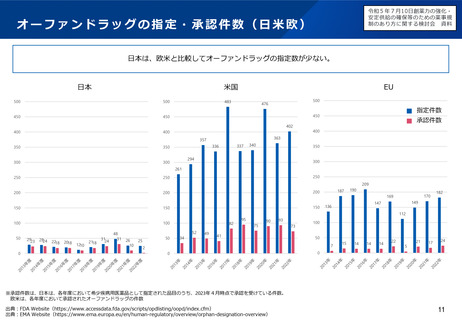
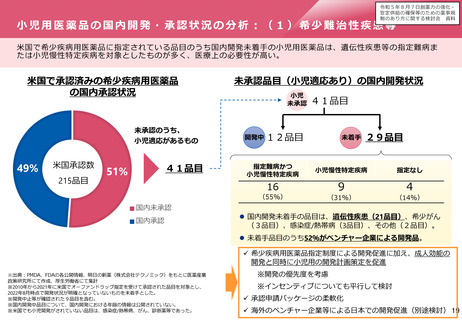
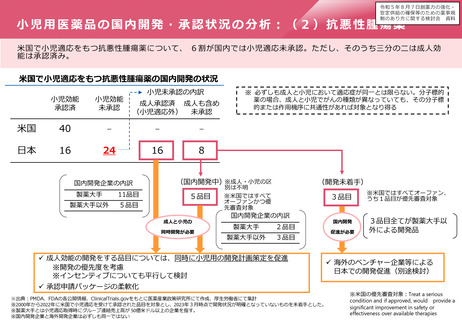
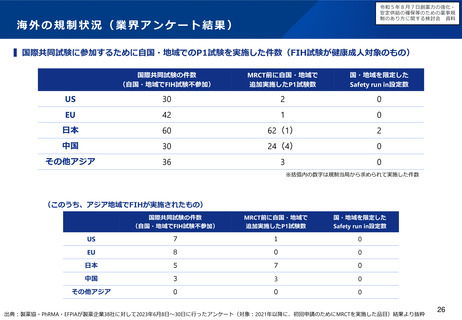
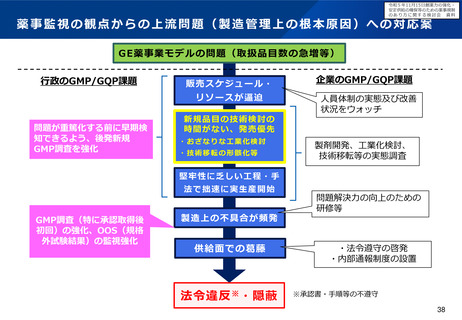
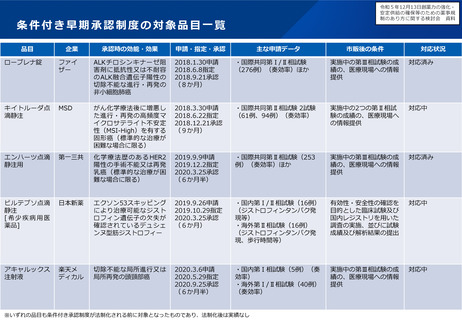
小児用医薬品の開発促進の必要性
令和5年7月10日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
注:ここでの小児は、新生児~15歳程度を想定(疾患によっては、低出生体重児等も含まれる場合が考えられる。)
▍小児用医薬品開発の課題
• 小児用医薬品の開発は、日本だけでなく国際的にも、市場規模が
小さいことや治験実施の困難さ(症例集積性、コスト)等の理由
から、一般的に開発が進みにくいことが指摘されている。
• 近年拡大が懸念されている「ドラッグ・ロス」の問題においても、
特に、希少疾病用とともに、小児用の医薬品でのロスが課題と
なっている。
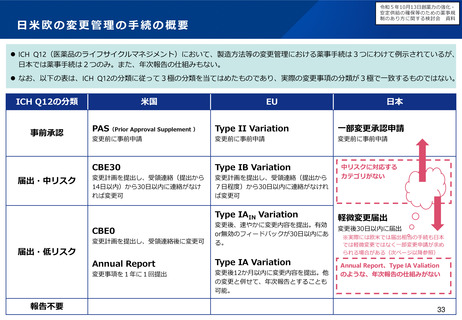
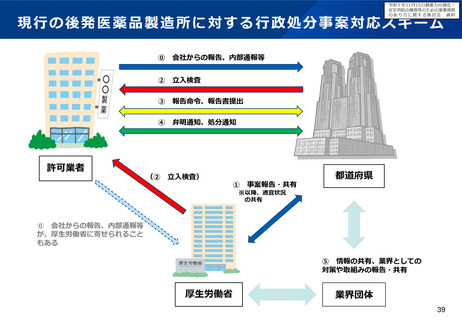
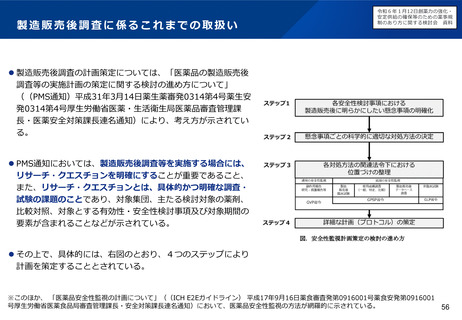
現状の取組について
特定用途医薬品指定制度
再審査期間の運用
• これまで、我が国では、特定用途医薬品指定制度の創設、再審査
期間の運用見直し等(※1)の対応を進めてきたが、更なる取組に
よる小児用医薬品の開発促進が求められている。
※1 小児に対応した治験環境の整備や薬価上の措置を含む。
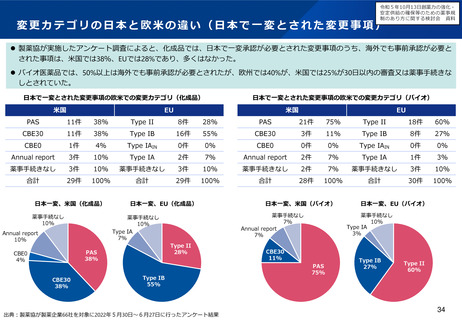
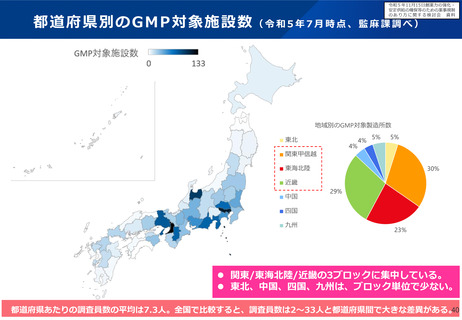
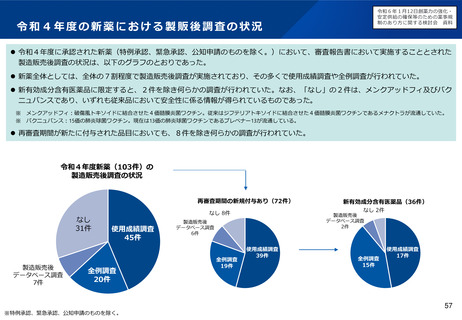
▍検討の方向性
• 欧米では、その対策の一つとして、成人の医薬品開発時に小児用
医薬品の開発計画策定を義務づける等の取組を行っている。
• 欧米の制度を参考にしつつ、我が国の状況も踏まえながら(※2)、
小児用医薬品開発を成人用と同時に進めるための仕組みや、その
実効性を高めるための対応について、検討する必要があると考え
られる。
※2 厚生労働科学特別研究「小児がん及び小児希少難治性疾患に係る医薬品開発
の推進制度に資する調査研究」において、海外制度の調査や国内関係者へのア
ンケートを実施。
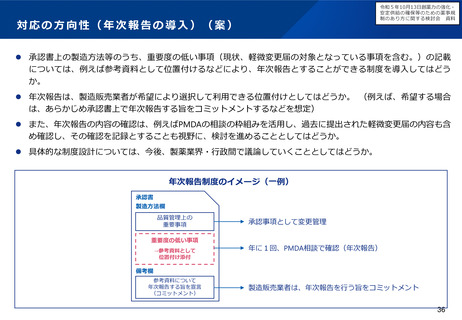
新たな小児用医薬品開発促進策
21
令和5年7月10日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
注:ここでの小児は、新生児~15歳程度を想定(疾患によっては、低出生体重児等も含まれる場合が考えられる。)
▍小児用医薬品開発の課題
• 小児用医薬品の開発は、日本だけでなく国際的にも、市場規模が
小さいことや治験実施の困難さ(症例集積性、コスト)等の理由
から、一般的に開発が進みにくいことが指摘されている。
• 近年拡大が懸念されている「ドラッグ・ロス」の問題においても、
特に、希少疾病用とともに、小児用の医薬品でのロスが課題と
なっている。
現状の取組について
特定用途医薬品指定制度
再審査期間の運用
• これまで、我が国では、特定用途医薬品指定制度の創設、再審査
期間の運用見直し等(※1)の対応を進めてきたが、更なる取組に
よる小児用医薬品の開発促進が求められている。
※1 小児に対応した治験環境の整備や薬価上の措置を含む。
▍検討の方向性
• 欧米では、その対策の一つとして、成人の医薬品開発時に小児用
医薬品の開発計画策定を義務づける等の取組を行っている。
• 欧米の制度を参考にしつつ、我が国の状況も踏まえながら(※2)、
小児用医薬品開発を成人用と同時に進めるための仕組みや、その
実効性を高めるための対応について、検討する必要があると考え
られる。
※2 厚生労働科学特別研究「小児がん及び小児希少難治性疾患に係る医薬品開発
の推進制度に資する調査研究」において、海外制度の調査や国内関係者へのア
ンケートを実施。
新たな小児用医薬品開発促進策
21