よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和5年8月7日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
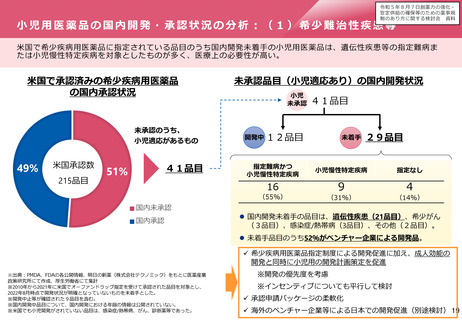
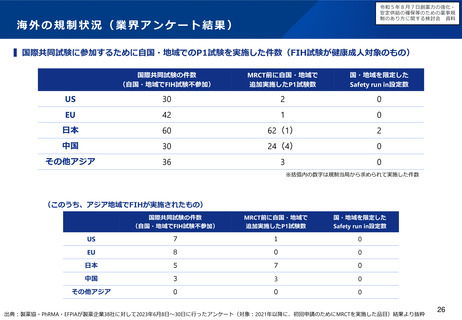
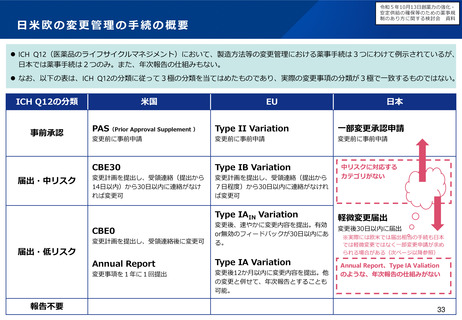
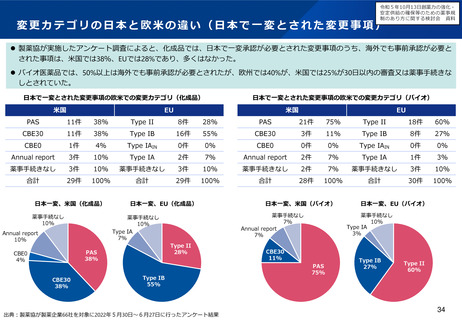
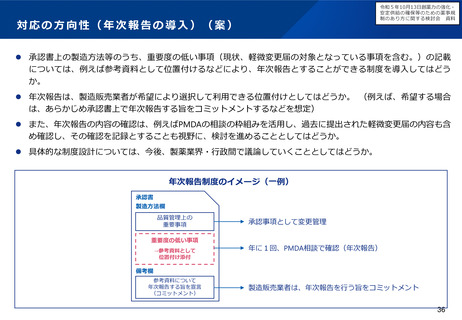
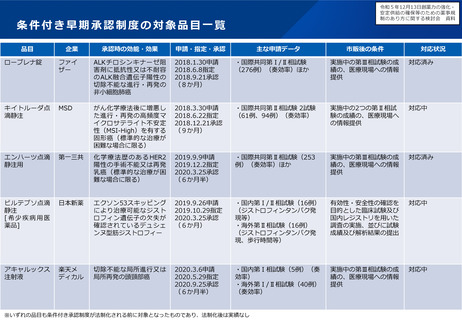
小児用医薬品の国内開発・承認状況の分析:(1)希少難治性疾患等
米国で希少疾病用医薬品に指定されている品目のうち国内開発未着手の小児用医薬品は、遺伝性疾患等の指定難病ま
たは小児慢性特定疾病を対象としたものが多く、医療上の必要性が高い。
米国で承認済みの希少疾病用医薬品
の国内承認状況
未承認のうち、
小児適応があるもの
49%
米国承認数
215品目
41品目
51%
未承認品目(小児適応あり)の国内開発状況
小児
未承認 41品目
開発中 12品目
未着手 29品目
指定難病かつ
小児慢性特定疾病
小児慢性特定疾病
指定なし
16
9
4
(55%)
(31%)
(14%)
国内未承認
国内承認
⚫ 国内開発未着手の品目は、遺伝性疾患(21品目)、希少がん
(3品目)、感染症/熱帯病(3品目)、その他(2品目)。
⚫ 未着手品目のうち52%がベンチャー企業による開発品。
✓ 希少疾病用医薬品指定制度による開発促進に加え、成人効能の
開発と同時に小児用の開発計画策定を促進
※出典:PMDA、FDAの各公開情報、明日の新薬(株式会社テクノミック)をもとに医薬産業
政策研究所にて作成、厚生労働省にて集計
※2010年から2021年に米国でオーファンドラッグ指定を受けて承認された品目を対象とし、
2022年8月時点で開発状況が明確となっていないものを未着手とした。
※開発中止等が確認された9品目を含む。
※国内開発中品目について、国内開発における年齢の情報は公開されていない。
※米国でも小児開発がされていない品目は、感染症/熱帯病、がん、診断薬等であった。
※開発の優先度を考慮
※インセンティブについても平行して検討
✓ 承認申請パッケージの柔軟化
✓ 海外のベンチャー企業等による日本での開発促進(別途検討) 19
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
小児用医薬品の国内開発・承認状況の分析:(1)希少難治性疾患等
米国で希少疾病用医薬品に指定されている品目のうち国内開発未着手の小児用医薬品は、遺伝性疾患等の指定難病ま
たは小児慢性特定疾病を対象としたものが多く、医療上の必要性が高い。
米国で承認済みの希少疾病用医薬品
の国内承認状況
未承認のうち、
小児適応があるもの
49%
米国承認数
215品目
41品目
51%
未承認品目(小児適応あり)の国内開発状況
小児
未承認 41品目
開発中 12品目
未着手 29品目
指定難病かつ
小児慢性特定疾病
小児慢性特定疾病
指定なし
16
9
4
(55%)
(31%)
(14%)
国内未承認
国内承認
⚫ 国内開発未着手の品目は、遺伝性疾患(21品目)、希少がん
(3品目)、感染症/熱帯病(3品目)、その他(2品目)。
⚫ 未着手品目のうち52%がベンチャー企業による開発品。
✓ 希少疾病用医薬品指定制度による開発促進に加え、成人効能の
開発と同時に小児用の開発計画策定を促進
※出典:PMDA、FDAの各公開情報、明日の新薬(株式会社テクノミック)をもとに医薬産業
政策研究所にて作成、厚生労働省にて集計
※2010年から2021年に米国でオーファンドラッグ指定を受けて承認された品目を対象とし、
2022年8月時点で開発状況が明確となっていないものを未着手とした。
※開発中止等が確認された9品目を含む。
※国内開発中品目について、国内開発における年齢の情報は公開されていない。
※米国でも小児開発がされていない品目は、感染症/熱帯病、がん、診断薬等であった。
※開発の優先度を考慮
※インセンティブについても平行して検討
✓ 承認申請パッケージの柔軟化
✓ 海外のベンチャー企業等による日本での開発促進(別途検討) 19