よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
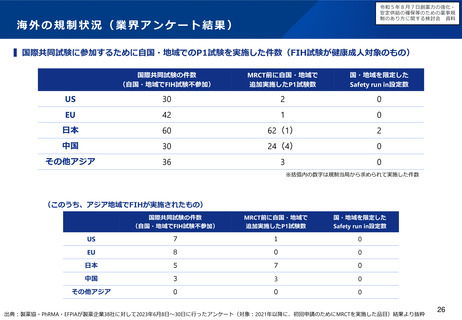
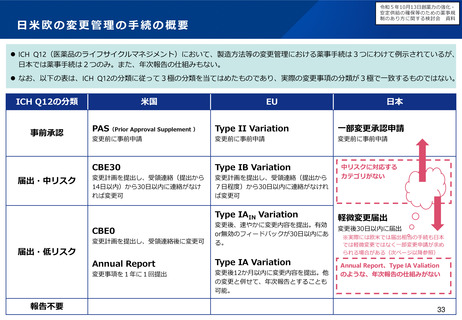
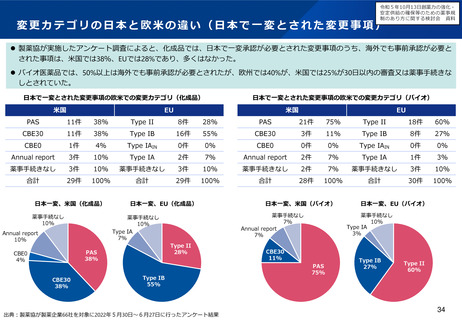
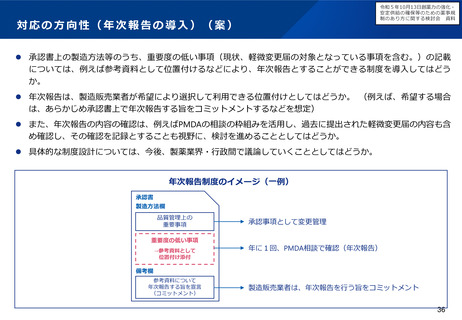
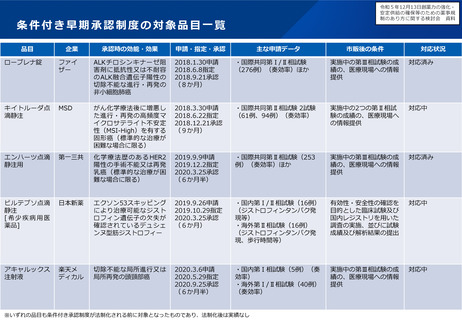
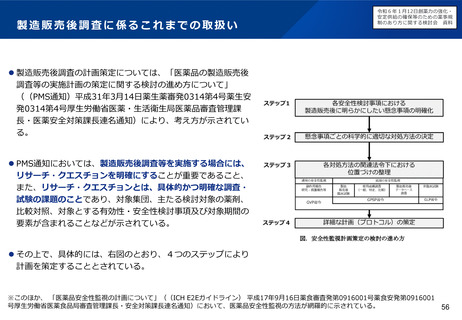
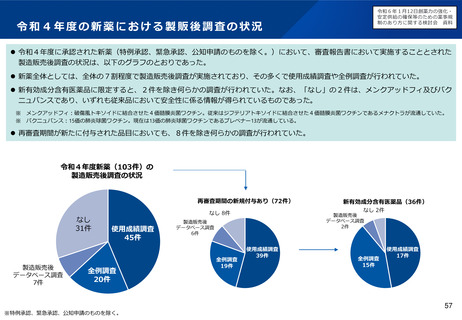
小児用医薬品の開発を促進する仕組みについて
令和5年7月10日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
主な課題
対応の方向性(案)
▍小児用医薬品の開発を促す方策
▍成人と同時に小児用の開発計画策定を促す仕組みの導入
• 欧米同様に小児用の開発を義務付けるべきでは
ないかという意見がある一方、義務化すること
で成人を含めて我が国での医薬品開発が滞る可
能性も考えられる。
• 新有効成分、新効能の医薬品については、成人用の開発
時に、企業判断で小児用の開発計画を策定し、PMDAが
確認する仕組みを設けてはどうか。
• もともと少ない小児患者に対して、義務づけに
より、治験参加者の募集や上市後において、競
合による非効率が生じるのではないか。
• 義務化されている欧米においても、実際には、
免除や猶予の規定があり、その適用を求めて企
業と審査当局との間で多くの折衝が行われてお
り、また、小児剤形について同時開発は必ずし
も達成できていない、という意見もある。
• 確認された計画について、必要な準備を進めた上で、治
験届を提出することとしてはどうか。
※ 必ずしも成人と小児において適応症が同一とは限らない。例えば、が
んを対象とした分子標的薬の場合、成人と小児でがんの種類が異なっ
ていても、その分子標的または作用機序に共通性があれば対象となり
得るのではないか。
※ 企業による開発計画策定を促すインセンティブについても別途検討
• 既承認医薬品については、特定用途医薬品指定制度を引
き続き活用しつつ、更なる活用に向けた制度のあり方を
検討することとしてはどうか。
▍開発優先度の明確化
• 小児用の開発の優先度については、企業の判断によるほ
か、専門学会等の要望や評価を踏まえ、優先度に関する
検討を行い、結果を公表してはどうか。
• これにより、企業の開発計画に示唆を与えたり、優先度
の高い品目の開発に関して産官学で協力がしやすくなる
のではないか。
22
令和5年7月10日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
主な課題
対応の方向性(案)
▍小児用医薬品の開発を促す方策
▍成人と同時に小児用の開発計画策定を促す仕組みの導入
• 欧米同様に小児用の開発を義務付けるべきでは
ないかという意見がある一方、義務化すること
で成人を含めて我が国での医薬品開発が滞る可
能性も考えられる。
• 新有効成分、新効能の医薬品については、成人用の開発
時に、企業判断で小児用の開発計画を策定し、PMDAが
確認する仕組みを設けてはどうか。
• もともと少ない小児患者に対して、義務づけに
より、治験参加者の募集や上市後において、競
合による非効率が生じるのではないか。
• 義務化されている欧米においても、実際には、
免除や猶予の規定があり、その適用を求めて企
業と審査当局との間で多くの折衝が行われてお
り、また、小児剤形について同時開発は必ずし
も達成できていない、という意見もある。
• 確認された計画について、必要な準備を進めた上で、治
験届を提出することとしてはどうか。
※ 必ずしも成人と小児において適応症が同一とは限らない。例えば、が
んを対象とした分子標的薬の場合、成人と小児でがんの種類が異なっ
ていても、その分子標的または作用機序に共通性があれば対象となり
得るのではないか。
※ 企業による開発計画策定を促すインセンティブについても別途検討
• 既承認医薬品については、特定用途医薬品指定制度を引
き続き活用しつつ、更なる活用に向けた制度のあり方を
検討することとしてはどうか。
▍開発優先度の明確化
• 小児用の開発の優先度については、企業の判断によるほ
か、専門学会等の要望や評価を踏まえ、優先度に関する
検討を行い、結果を公表してはどうか。
• これにより、企業の開発計画に示唆を与えたり、優先度
の高い品目の開発に関して産官学で協力がしやすくなる
のではないか。
22