よむ、つかう、まなぶ。
【参考1】新型コロナウイルス感染症COVID-19診療の手引き 第10.0版 (48 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00416.html |
| 出典情報 | 「新型コロナウイルス感染症(COVID-19)診療の手引き・第 10.0 版」の 周知について(8/21付 事務連絡)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
●新型コロナウイルス感染症(COVID-19) 診療の手引き・第 10.0 版 ●5 薬物療法
・新型コロナワクチンの被接種者は臨床試験で除外されているため,ブレイクスルー感染で
の重症化予防などの有効性を裏づけるデータは得られていない.
・本剤の投与中は患者をモニターするとともに,投与完了後少なくとも 1 時間は観察する.
また,アナフィラキシーや急性輸注反応を含む重篤な過敏症が,投与中から投与 24 時間
後にかけて起きることがある.
特定の背景のある患者への投与
〔妊婦〕治療上の有益性が危険性を上回ると判断される場合にのみ投与すること.
〔授乳婦〕治療上の有益性および母乳栄養の有益性を考慮し,授乳の継続または中止を検
討すること.
〔小児等〕12 際未満の小児等を対象とした臨床試験は実施されていない.
〔高齢者〕患者の状態を観察しながら慎重に投与すること.
入手方法
・本剤(カシリビマブ/イムデビマブ)は安定的な入手が可能になるまでは,一般流通は
行われず,厚生労働省が所有したうえで,対象となる患者が発生した医療機関からの依頼
に基づき,無償で配分される.詳細は最新の事務連絡を参照すること.
ソトロビマブ
商品名:ゼビュディ点滴静注液 500mg
2021.9.27 特例承認
本剤はオミクロンに対して有効性が減弱していると考えられることから,抗ウイルス薬の
投与を優先して検討すること.
禁忌 本剤の成分に対し過敏症の既往歴のある患者
☞ ソトロビマブ(遺伝子組換え)
(医薬品医療機器総合機構 HP)
本剤は SARS に感染した患者から得られた抗体を基にしたモノクローナル抗体であり,
SARS-CoV-2 を含むベータコロナウイルス属サルベコウイルス亜属に対して抗ウイルス作用
を発揮することが期待されている中和抗体薬である.Fc 領域に LS と呼ばれる修飾が入ること
で長い半減期を達成している.カシリビマブ/イムデビマブと同様に,発症から時間の経って
いない軽症例において重症化を抑制する効果が示されている.
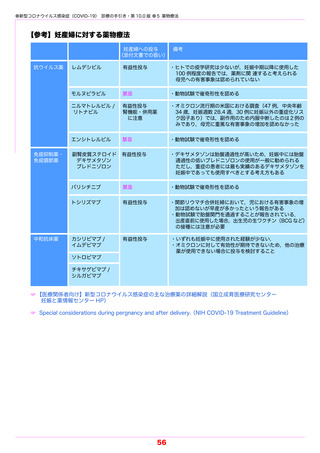
少なくとも 1 つ以上の重症化リスク因子をもつ軽症 COVID-19 患者を対象とした第Ⅲ相の
ランダム化比較試験では,中間解析においてソトロビマブ 500 mg 単回投与群(291 名)は,
プラセボ投与群(292 名)と比較して,主要評価項目である投与 29 日目までの入院または死
亡が 85 % 減少した(8 % vs 1 %).また重篤な有害事象は,ソトロビマブ投与群で 2 %,プ
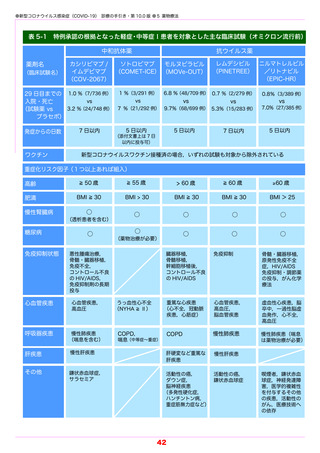
ラセボ投与群で 6 %と,ソトロビマブ投与群の方が少なかった(表 5-1)
.
投与方法(用法・用量)
<発症後の重症化抑制>
〔成人および 12 歳以上かつ体重 40 kg 以上の小児〕ソトロビマブ 500 mg を単回点滴
静注する.
48
・新型コロナワクチンの被接種者は臨床試験で除外されているため,ブレイクスルー感染で
の重症化予防などの有効性を裏づけるデータは得られていない.
・本剤の投与中は患者をモニターするとともに,投与完了後少なくとも 1 時間は観察する.
また,アナフィラキシーや急性輸注反応を含む重篤な過敏症が,投与中から投与 24 時間
後にかけて起きることがある.
特定の背景のある患者への投与
〔妊婦〕治療上の有益性が危険性を上回ると判断される場合にのみ投与すること.
〔授乳婦〕治療上の有益性および母乳栄養の有益性を考慮し,授乳の継続または中止を検
討すること.
〔小児等〕12 際未満の小児等を対象とした臨床試験は実施されていない.
〔高齢者〕患者の状態を観察しながら慎重に投与すること.
入手方法
・本剤(カシリビマブ/イムデビマブ)は安定的な入手が可能になるまでは,一般流通は
行われず,厚生労働省が所有したうえで,対象となる患者が発生した医療機関からの依頼
に基づき,無償で配分される.詳細は最新の事務連絡を参照すること.
ソトロビマブ
商品名:ゼビュディ点滴静注液 500mg
2021.9.27 特例承認
本剤はオミクロンに対して有効性が減弱していると考えられることから,抗ウイルス薬の
投与を優先して検討すること.
禁忌 本剤の成分に対し過敏症の既往歴のある患者
☞ ソトロビマブ(遺伝子組換え)
(医薬品医療機器総合機構 HP)
本剤は SARS に感染した患者から得られた抗体を基にしたモノクローナル抗体であり,
SARS-CoV-2 を含むベータコロナウイルス属サルベコウイルス亜属に対して抗ウイルス作用
を発揮することが期待されている中和抗体薬である.Fc 領域に LS と呼ばれる修飾が入ること
で長い半減期を達成している.カシリビマブ/イムデビマブと同様に,発症から時間の経って
いない軽症例において重症化を抑制する効果が示されている.
少なくとも 1 つ以上の重症化リスク因子をもつ軽症 COVID-19 患者を対象とした第Ⅲ相の
ランダム化比較試験では,中間解析においてソトロビマブ 500 mg 単回投与群(291 名)は,
プラセボ投与群(292 名)と比較して,主要評価項目である投与 29 日目までの入院または死
亡が 85 % 減少した(8 % vs 1 %).また重篤な有害事象は,ソトロビマブ投与群で 2 %,プ
ラセボ投与群で 6 %と,ソトロビマブ投与群の方が少なかった(表 5-1)
.
投与方法(用法・用量)
<発症後の重症化抑制>
〔成人および 12 歳以上かつ体重 40 kg 以上の小児〕ソトロビマブ 500 mg を単回点滴
静注する.
48