よむ、つかう、まなぶ。
【参考1】新型コロナウイルス感染症COVID-19診療の手引き 第10.0版 (43 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00416.html |
| 出典情報 | 「新型コロナウイルス感染症(COVID-19)診療の手引き・第 10.0 版」の 周知について(8/21付 事務連絡)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
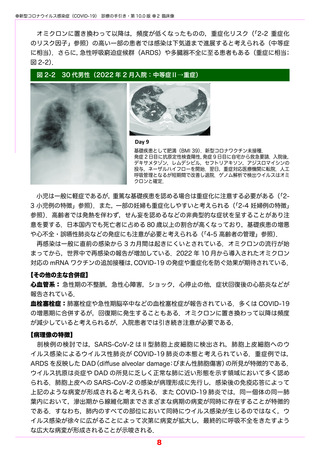
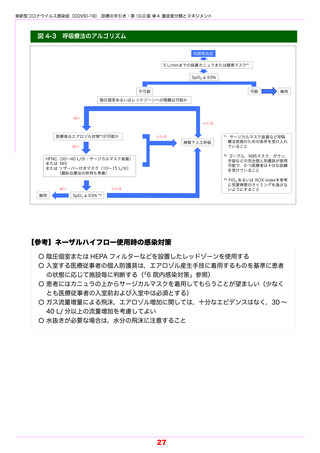
●新型コロナウイルス感染症(COVID-19) 診療の手引き・第 10.0 版 ●5 薬物療法
エンシトレルビル
商品名:ゾコーバ錠 125 mg
プロテアーゼ阻害薬
2022.11.22 緊急承認,2023.3.15 保険適用,2023.3.31 一般流通開始
禁忌 ①本剤の成分に対し過敏症の既往歴のある患者
②特定の薬剤を投与中の患者(最新の添付文書を参照)
③腎機能または肝機能障害のある患者で,コルヒチンを投与中の患者
④妊娠または妊娠している可能性のある女性
☞ エンシトレルビル フマル酸(医薬品医療機器総合機構 HP)
本剤は,本邦で緊急承認されたものであり,承認時において有効性および安全性に係る情
報は限られており,引き続き情報を収集中である.そのため,本剤の使用に当たっては,
あらかじめ患者または代諾者に,その旨ならびに有効性および安全性に関する情報を十分
に説明し,文書による同意を得てから投与すること.
エンシトレルビルは SARS-CoV-2 のメイン(3CL)プロテアーゼを阻害し,ポリタンパク
質の切断を阻止することによりウイルスの複製を阻害する.
開発企業の社内資料によれば,12 歳以上 70 歳未満の患者を対象に,1 日目は本剤 375 mg
を,2 日目〜 5 日目は本剤 125 mg を 1 日 1 回経口投与するランダム化二重盲検国際共同第
Ⅱ / Ⅲ相試験(T1221 試験)が実施された.参加した 1,215 例(日本人 662 例)のうち,
COVID-19 の症状発現から 72 時間以内に割付された 690 例(解析対象は投与群 336 例,プ
ラセボ群 321 例)において,5 症状(倦怠感・疲労感,体熱感・発熱,鼻汁・鼻閉,咽頭痛,
咳)が快復するまでの時間(中央値)は,
投与群で 167.9 時間,
プラセボ群で 192.2 時間であっ
た(p=0.0407).副作用発現頻度は 24.5%(148/604 例)であり,主な副作用は高比重リポ
蛋白の減少であった(18.4%).
本剤は 2022 年 2 月 25 日に開発企業から承認申請された.7 月 20 日の薬事・食品衛生審
議会薬事分科会・医薬品第二部会合同会議では継続審議となったが,11 月 22 日に同会議は緊
急承認を認めた.
投与方法(用法・用量)
〔12 歳以上の小児および成人〕エンシトレルビルとして,1 日目は 375 mg,2 日目〜
5 日目は 125 mg を 1 日 1 回経口投与する.
投与時の注意点
・一般に,重症化リスク因子のない軽症例では,経過観察のみで自然に軽快するが多いこ
とに留意する(「4-2 外来診療」参照)
.
・COVID-19 の 5 症状(上記を参照)への効果が検討された臨床試験における成績など
を踏まえ,高熱・強い咳症状・強い咽頭痛などの臨床症状がある者に処方を検討するこ
と.また,本剤の処方の対象者に関しては,今後の臨床試験等の結果も踏まえた検討が
必要となる.
・本剤の有効性は症状発現から 3 日目までに投与開始された患者において推定されており,
SARS-CoV-2 による感染症の症状が発現してから遅くとも 72 時間以内に初回投与すること.
43
エンシトレルビル
商品名:ゾコーバ錠 125 mg
プロテアーゼ阻害薬
2022.11.22 緊急承認,2023.3.15 保険適用,2023.3.31 一般流通開始
禁忌 ①本剤の成分に対し過敏症の既往歴のある患者
②特定の薬剤を投与中の患者(最新の添付文書を参照)
③腎機能または肝機能障害のある患者で,コルヒチンを投与中の患者
④妊娠または妊娠している可能性のある女性
☞ エンシトレルビル フマル酸(医薬品医療機器総合機構 HP)
本剤は,本邦で緊急承認されたものであり,承認時において有効性および安全性に係る情
報は限られており,引き続き情報を収集中である.そのため,本剤の使用に当たっては,
あらかじめ患者または代諾者に,その旨ならびに有効性および安全性に関する情報を十分
に説明し,文書による同意を得てから投与すること.
エンシトレルビルは SARS-CoV-2 のメイン(3CL)プロテアーゼを阻害し,ポリタンパク
質の切断を阻止することによりウイルスの複製を阻害する.
開発企業の社内資料によれば,12 歳以上 70 歳未満の患者を対象に,1 日目は本剤 375 mg
を,2 日目〜 5 日目は本剤 125 mg を 1 日 1 回経口投与するランダム化二重盲検国際共同第
Ⅱ / Ⅲ相試験(T1221 試験)が実施された.参加した 1,215 例(日本人 662 例)のうち,
COVID-19 の症状発現から 72 時間以内に割付された 690 例(解析対象は投与群 336 例,プ
ラセボ群 321 例)において,5 症状(倦怠感・疲労感,体熱感・発熱,鼻汁・鼻閉,咽頭痛,
咳)が快復するまでの時間(中央値)は,
投与群で 167.9 時間,
プラセボ群で 192.2 時間であっ
た(p=0.0407).副作用発現頻度は 24.5%(148/604 例)であり,主な副作用は高比重リポ
蛋白の減少であった(18.4%).
本剤は 2022 年 2 月 25 日に開発企業から承認申請された.7 月 20 日の薬事・食品衛生審
議会薬事分科会・医薬品第二部会合同会議では継続審議となったが,11 月 22 日に同会議は緊
急承認を認めた.
投与方法(用法・用量)
〔12 歳以上の小児および成人〕エンシトレルビルとして,1 日目は 375 mg,2 日目〜
5 日目は 125 mg を 1 日 1 回経口投与する.
投与時の注意点
・一般に,重症化リスク因子のない軽症例では,経過観察のみで自然に軽快するが多いこ
とに留意する(「4-2 外来診療」参照)
.
・COVID-19 の 5 症状(上記を参照)への効果が検討された臨床試験における成績など
を踏まえ,高熱・強い咳症状・強い咽頭痛などの臨床症状がある者に処方を検討するこ
と.また,本剤の処方の対象者に関しては,今後の臨床試験等の結果も踏まえた検討が
必要となる.
・本剤の有効性は症状発現から 3 日目までに投与開始された患者において推定されており,
SARS-CoV-2 による感染症の症状が発現してから遅くとも 72 時間以内に初回投与すること.
43