よむ、つかう、まなぶ。
04資料1-2 高齢者に対する肺炎球菌ワクチンについて[2.1MB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_70339.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第64回 2/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
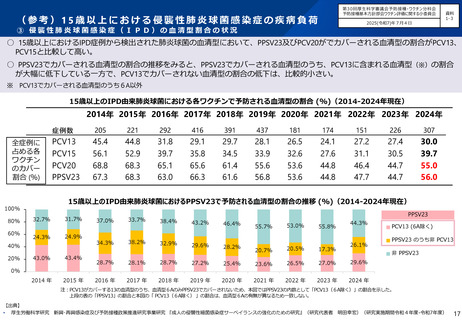
高齢者に対する肺炎球菌ワクチンに係る
副反応疑い報告基準の設定について
第110回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、
令和7年度第11回薬事審議会医薬品等安全対策部会安全対策調査会(合同開催)
2026(令和8)年2月4日
資料
5
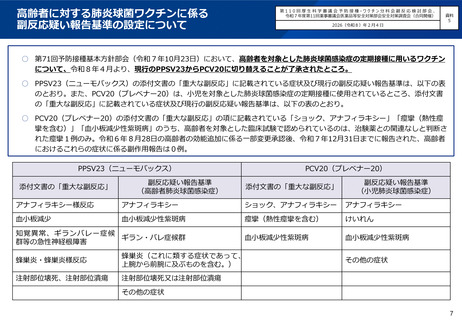
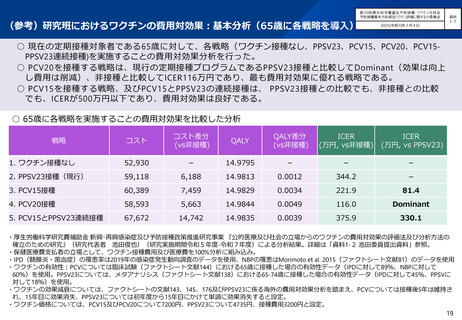
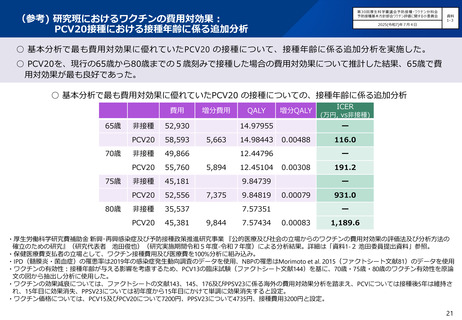
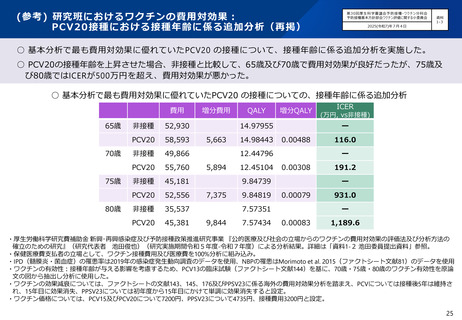
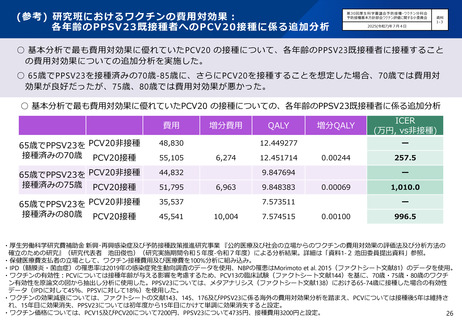
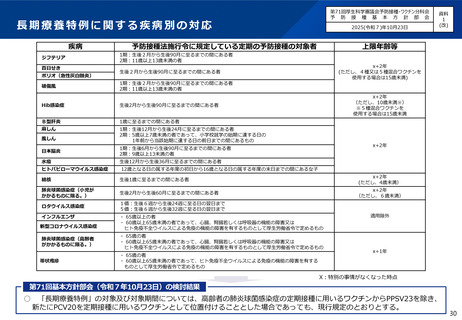
○ 第71回予防接種基本方針部会(令和7年10月23日)において、高齢者を対象とした肺炎球菌感染症の定期接種に用いるワクチン
について、令和8年4月より、現行のPPSV23からPCV20に切り替えることが了承されたところ。
○ PPSV23(ニューモバックス)の添付文書の「重大な副反応」に記載されている症状及び現行の副反応疑い報告基準は、以下の表
のとおり。また、PCV20(プレベナー20)は、小児を対象とした肺炎球菌感染症の定期接種に使用されているところ、添付文書
の「重大な副反応」に記載されている症状及び現行の副反応疑い報告基準は、以下の表のとおり。
○ PCV20(プレベナー20)の添付文書の「重大な副反応」の項に記載されている「ショック、アナフィラキシー」「痙攣(熱性痙
攣を含む)」「血小板減少性紫斑病」のうち、高齢者を対象とした臨床試験で認められているのは、治験薬との関連なしと判断さ
れた痙攣1例のみ。令和6年8月28日の高齢者の効能追加に係る一部変更承認後、令和7年12月31日までに報告された、高齢者
におけるこれらの症状に係る副作用報告は0例。
PPSV23(ニューモバックス)
添付文書の「重大な副反応」
PCV20(プレベナー20)
副反応疑い報告基準
(高齢者肺炎球菌感染症)
添付文書の「重大な副反応」
副反応疑い報告基準
(小児肺炎球菌感染症)
アナフィラキシー様反応
アナフィラキシー
ショック、アナフィラキシー
アナフィラキシー
血小板減少
血小板減少性紫斑病
痙攣(熱性痙攣を含む)
けいれん
血小板減少性紫斑病
血小板減少性紫斑病
知覚異常、ギランバレー症候
ギラン・バレ症候群
群等の急性神経根障害
蜂巣炎・蜂巣炎様反応
蜂巣炎(これに類する症状であって、
上腕から前腕に及ぶものを含む。)
注射部位壊死、注射部位潰瘍
注射部位壊死又は注射部位潰瘍
その他の症状
その他の症状
7
副反応疑い報告基準の設定について
第110回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、
令和7年度第11回薬事審議会医薬品等安全対策部会安全対策調査会(合同開催)
2026(令和8)年2月4日
資料
5
○ 第71回予防接種基本方針部会(令和7年10月23日)において、高齢者を対象とした肺炎球菌感染症の定期接種に用いるワクチン
について、令和8年4月より、現行のPPSV23からPCV20に切り替えることが了承されたところ。
○ PPSV23(ニューモバックス)の添付文書の「重大な副反応」に記載されている症状及び現行の副反応疑い報告基準は、以下の表
のとおり。また、PCV20(プレベナー20)は、小児を対象とした肺炎球菌感染症の定期接種に使用されているところ、添付文書
の「重大な副反応」に記載されている症状及び現行の副反応疑い報告基準は、以下の表のとおり。
○ PCV20(プレベナー20)の添付文書の「重大な副反応」の項に記載されている「ショック、アナフィラキシー」「痙攣(熱性痙
攣を含む)」「血小板減少性紫斑病」のうち、高齢者を対象とした臨床試験で認められているのは、治験薬との関連なしと判断さ
れた痙攣1例のみ。令和6年8月28日の高齢者の効能追加に係る一部変更承認後、令和7年12月31日までに報告された、高齢者
におけるこれらの症状に係る副作用報告は0例。
PPSV23(ニューモバックス)
添付文書の「重大な副反応」
PCV20(プレベナー20)
副反応疑い報告基準
(高齢者肺炎球菌感染症)
添付文書の「重大な副反応」
副反応疑い報告基準
(小児肺炎球菌感染症)
アナフィラキシー様反応
アナフィラキシー
ショック、アナフィラキシー
アナフィラキシー
血小板減少
血小板減少性紫斑病
痙攣(熱性痙攣を含む)
けいれん
血小板減少性紫斑病
血小板減少性紫斑病
知覚異常、ギランバレー症候
ギラン・バレ症候群
群等の急性神経根障害
蜂巣炎・蜂巣炎様反応
蜂巣炎(これに類する症状であって、
上腕から前腕に及ぶものを含む。)
注射部位壊死、注射部位潰瘍
注射部位壊死又は注射部位潰瘍
その他の症状
その他の症状
7