よむ、つかう、まなぶ。
【資料3-1】ゲノム編集技術等を用いたヒト受精胚等の取扱い等に関する合同会議「議論の整理」 (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_67012.html |
| 出典情報 | 厚生科学審議会 科学技術部会(第146回 12/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
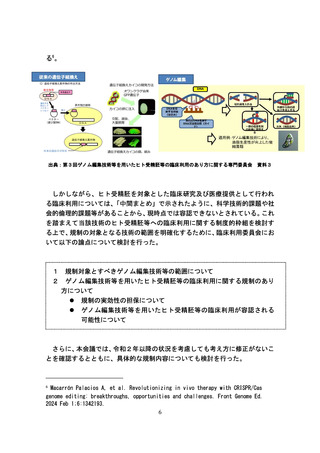
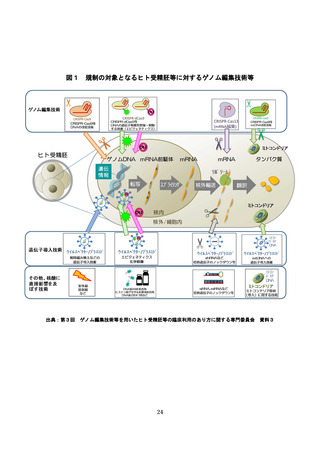
2.ゲノム編集技術等を用いたヒト受精胚等の臨床利用に関する規制のあり方
について
ゲノム編集技術等を用いたヒト受精胚等の臨床利用に関する規制のあり方を
検討する上で、諸外国における規制の状況や、臨床利用に関する検討状況を把握
することは重要である。令和6年度厚生労働科学特別研究事業である「ゲノム編
集技術等が用いられたヒト胚等の臨床利用の規制方法の検討のための研究(主
任研究者:山口照英、日本薬科大学・薬学部・客員教授)」によると、現在の海
外での規制状況は以下のとおりである。
2-1)規制の実効性の担保について
(1)諸外国の規制状況
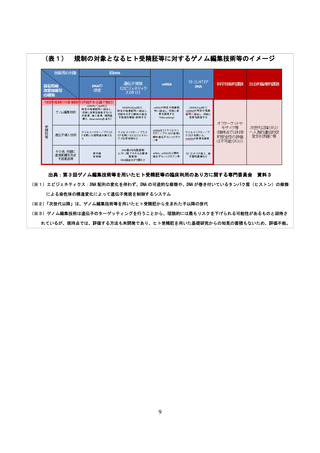
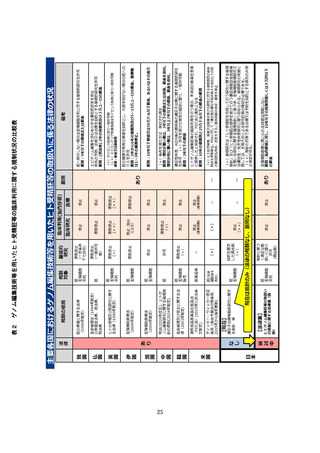
上記研究事業の中間報告によると諸外国の現状の規制状況は、以下のとおり
法律で罰則をもって規制されている国が多い。(参考資料表2)
・英国、独国、仏国等においては、ゲノム編集技術等を用いたヒト受精胚の
臨床利用に関しては個別法により罰則をもって禁止されている。
・米国においては、歳出予算法の中で、当該技術を用いたヒト受精胚に関す
る臨床試験の承認審査を禁止しており、それにも関わらずヒトゲノム編集
胚等の臨床利用を行った場合、未承認の新薬を患者に提供したと判断され、
連邦食品医薬品化粧品法違反となる
・中国においては、生殖医療における編集されたヒト胚の移植を刑法により
禁止している。
(2)我が国の規制状況
我が国のゲノム編集技術等を用いたヒト受精胚等の臨床研究に関しては、
「遺伝子治療等臨床研究に関する指針」(平成 31 年厚生労働省告示第 48 号。
以下「遺伝子指針」という。)第1章第1節第7「生殖細胞等を対象とする遺
伝子治療等臨床研究の禁止等」の規定により認められていない。
実臨床においては、公益社団法人日本産科婦人科学会では、「体外受精・胚
移植の実施に際しては、遺伝子操作を行わない」という規定が存在するものの、
あくまで、会告という学会員に対しての限定的な自主規制にとどまっており、
医療提供として行われる臨床利用全体に対しては、現時点では実効性のある規
制は存在しない。
10
について
ゲノム編集技術等を用いたヒト受精胚等の臨床利用に関する規制のあり方を
検討する上で、諸外国における規制の状況や、臨床利用に関する検討状況を把握
することは重要である。令和6年度厚生労働科学特別研究事業である「ゲノム編
集技術等が用いられたヒト胚等の臨床利用の規制方法の検討のための研究(主
任研究者:山口照英、日本薬科大学・薬学部・客員教授)」によると、現在の海
外での規制状況は以下のとおりである。
2-1)規制の実効性の担保について
(1)諸外国の規制状況
上記研究事業の中間報告によると諸外国の現状の規制状況は、以下のとおり
法律で罰則をもって規制されている国が多い。(参考資料表2)
・英国、独国、仏国等においては、ゲノム編集技術等を用いたヒト受精胚の
臨床利用に関しては個別法により罰則をもって禁止されている。
・米国においては、歳出予算法の中で、当該技術を用いたヒト受精胚に関す
る臨床試験の承認審査を禁止しており、それにも関わらずヒトゲノム編集
胚等の臨床利用を行った場合、未承認の新薬を患者に提供したと判断され、
連邦食品医薬品化粧品法違反となる
・中国においては、生殖医療における編集されたヒト胚の移植を刑法により
禁止している。
(2)我が国の規制状況
我が国のゲノム編集技術等を用いたヒト受精胚等の臨床研究に関しては、
「遺伝子治療等臨床研究に関する指針」(平成 31 年厚生労働省告示第 48 号。
以下「遺伝子指針」という。)第1章第1節第7「生殖細胞等を対象とする遺
伝子治療等臨床研究の禁止等」の規定により認められていない。
実臨床においては、公益社団法人日本産科婦人科学会では、「体外受精・胚
移植の実施に際しては、遺伝子操作を行わない」という規定が存在するものの、
あくまで、会告という学会員に対しての限定的な自主規制にとどまっており、
医療提供として行われる臨床利用全体に対しては、現時点では実効性のある規
制は存在しない。
10