よむ、つかう、まなぶ。
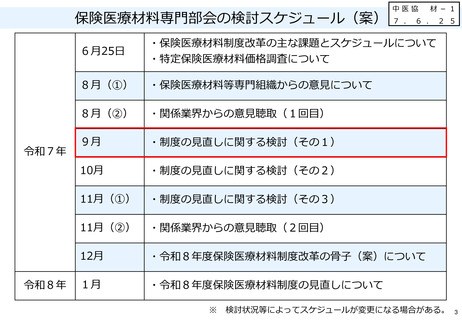
材ー1保険医療材料制度の見直しに関する検討(その1) (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_63930.html |
| 出典情報 | 中央社会保険医療協議会 保険医療材料専門部会(第131回 9/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
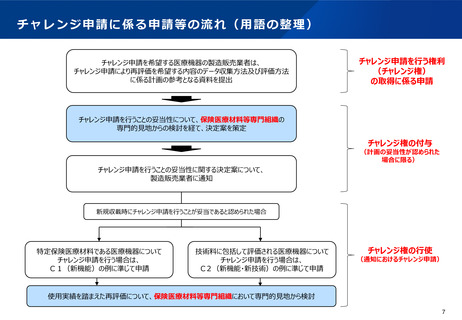
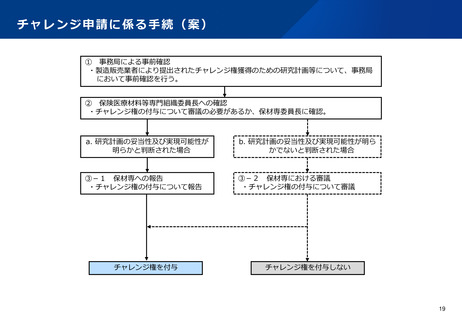
チャレンジ申請に係る手続
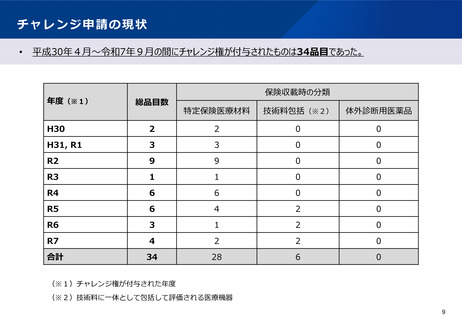
【現状】
•
令和2年度改定では、チャレンジ権の付与を希望する場合には、保険収載後のデータ収集及び評価方法に係る
計画を具体的に提示することを求めることとなった。
•
令和4年度改定では、チャレンジ権の付与を希望する際に希望書に記載するべき具体的な項目について明確化
された。
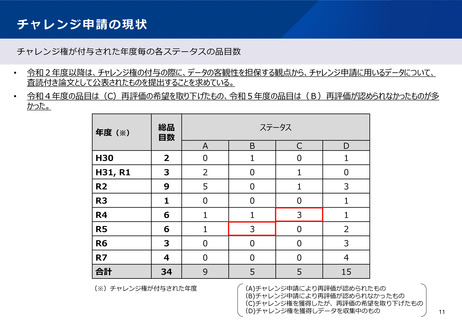
【課題】
•
チャレンジ申請に係る手続については、企業負担等にも配慮しながら、適切かつ迅速に進める必要がある。
•
近年、チャレンジ権を獲得したが再評価の希望を取り下げた事例及びチャレンジ申請を行ったものの再評価が
認められなかった事例が増加している。チャレンジ申請に係る手続において、研究計画の妥当性や実現可能性
等に関する十分な検討が必要と考えられる。
【論点】
•
既存治療との比較等により新たな知見を得られることが十分に期待でき、実現可能性も高いと考えられる研究
計画(RCTであり実現可能性も高いもの等)については、事務局による事前確認を経て保険医療材料等専門組
織委員長が認めた場合に限り、保険医療材料等専門組織への報告をもってチャレンジ権を付与できることとし
てはどうか。
•
そうでない場合は、研究計画について保険医療材料等専門組織で検討し、既存治療との比較が困難と判断され
るもの(対照が明確でないもの、バイアスが排除されていないもの等)や実現可能性が認められないもの等に
ついては、チャレンジ権を付与しないこととし、製造販売業者にその理由を伝達することとしてはどうか。
18
【現状】
•
令和2年度改定では、チャレンジ権の付与を希望する場合には、保険収載後のデータ収集及び評価方法に係る
計画を具体的に提示することを求めることとなった。
•
令和4年度改定では、チャレンジ権の付与を希望する際に希望書に記載するべき具体的な項目について明確化
された。
【課題】
•
チャレンジ申請に係る手続については、企業負担等にも配慮しながら、適切かつ迅速に進める必要がある。
•
近年、チャレンジ権を獲得したが再評価の希望を取り下げた事例及びチャレンジ申請を行ったものの再評価が
認められなかった事例が増加している。チャレンジ申請に係る手続において、研究計画の妥当性や実現可能性
等に関する十分な検討が必要と考えられる。
【論点】
•
既存治療との比較等により新たな知見を得られることが十分に期待でき、実現可能性も高いと考えられる研究
計画(RCTであり実現可能性も高いもの等)については、事務局による事前確認を経て保険医療材料等専門組
織委員長が認めた場合に限り、保険医療材料等専門組織への報告をもってチャレンジ権を付与できることとし
てはどうか。
•
そうでない場合は、研究計画について保険医療材料等専門組織で検討し、既存治療との比較が困難と判断され
るもの(対照が明確でないもの、バイアスが排除されていないもの等)や実現可能性が認められないもの等に
ついては、チャレンジ権を付与しないこととし、製造販売業者にその理由を伝達することとしてはどうか。
18