よむ、つかう、まなぶ。
【資料2-1】成分情報等 (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58149.html |
| 出典情報 | 医療用から要指導・一般用への転用に関する評価検討会議(第32回 5/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
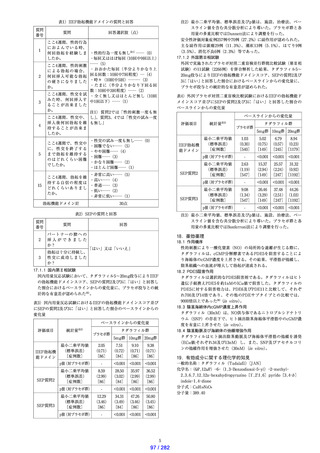
なお、シアリスは、2022 年 4 月 1 日より「勃起不全による
男性不妊」の治療目的で処方された場合にのみ保険給付の
対象となった。
治療学的特性
• 新しい構造式を持つ ED 治療剤である。
• 性的刺激により一酸化窒素(NO)の局所的な遊離が生じ
る際に、タダラフィルは、cGMP 分解酵素である PDE5 を
阻害することにより海綿体の cGMP 濃度を上昇させる。
その結果、海綿体小柱平滑筋が弛緩し、陰茎組織への血流
が増大して勃起が達成される。
治療学的・製
• 国内プラセボ対照二重盲検比較試験において、
「挿入の成
剤学的特性
功*」は 5mg で 72.1%、10mg で 81.1%、20 mg で 82.1%、
(インタビ
「性交の成功*」は、5mg で 51.4%、10mg で 64.6%、20mg
ューフォー
で 68.4%であった。
ム等より)22)
*患者日記中の性交に関する質問
• 有効性が 36 時間認められる。
• 食事の影響を受けない。
• 重大な副作用として、過敏症が報告されている。
製剤学的特性
特になし。
タダラフィルを含む PDE5 阻害剤の臨床的位置付けは ED
診療ガイドライン第 3 版にて以下のように示されている。
• ED に対する薬物治療として、本邦では 3 剤(シルデナフ
ィル、バルデナフィル、タダラフィル)が使用可能であり、
臨床での使
3 剤ともに国内外で十分な有効性・安全性のデータが報告
われ方
されており、第一選択の治療法である。
• タダラフィルは内服後 30 分から効果を発揮し、36 時間持
続する。この長時間持続する効果が、この薬剤と他 2 剤
との大きな違いである。
本邦では、タダラフィルは ED 治療剤としてだけでなく、
前立腺肥大症に伴う排尿障害改善剤(1 日 1 回 5mg 連日投
安全性に関
与)や、男性だけでなく女性での肺動脈性肺高血圧症(1 日
する情報(添
1 回 40mg 連日投与)の薬剤としても使用されている。また
付文書より) いずれも再審査が終了し、安全性および有効性が確認され
ている。
81 / 282
男性不妊」の治療目的で処方された場合にのみ保険給付の
対象となった。
治療学的特性
• 新しい構造式を持つ ED 治療剤である。
• 性的刺激により一酸化窒素(NO)の局所的な遊離が生じ
る際に、タダラフィルは、cGMP 分解酵素である PDE5 を
阻害することにより海綿体の cGMP 濃度を上昇させる。
その結果、海綿体小柱平滑筋が弛緩し、陰茎組織への血流
が増大して勃起が達成される。
治療学的・製
• 国内プラセボ対照二重盲検比較試験において、
「挿入の成
剤学的特性
功*」は 5mg で 72.1%、10mg で 81.1%、20 mg で 82.1%、
(インタビ
「性交の成功*」は、5mg で 51.4%、10mg で 64.6%、20mg
ューフォー
で 68.4%であった。
ム等より)22)
*患者日記中の性交に関する質問
• 有効性が 36 時間認められる。
• 食事の影響を受けない。
• 重大な副作用として、過敏症が報告されている。
製剤学的特性
特になし。
タダラフィルを含む PDE5 阻害剤の臨床的位置付けは ED
診療ガイドライン第 3 版にて以下のように示されている。
• ED に対する薬物治療として、本邦では 3 剤(シルデナフ
ィル、バルデナフィル、タダラフィル)が使用可能であり、
臨床での使
3 剤ともに国内外で十分な有効性・安全性のデータが報告
われ方
されており、第一選択の治療法である。
• タダラフィルは内服後 30 分から効果を発揮し、36 時間持
続する。この長時間持続する効果が、この薬剤と他 2 剤
との大きな違いである。
本邦では、タダラフィルは ED 治療剤としてだけでなく、
前立腺肥大症に伴う排尿障害改善剤(1 日 1 回 5mg 連日投
安全性に関
与)や、男性だけでなく女性での肺動脈性肺高血圧症(1 日
する情報(添
1 回 40mg 連日投与)の薬剤としても使用されている。また
付文書より) いずれも再審査が終了し、安全性および有効性が確認され
ている。
81 / 282