よむ、つかう、まなぶ。
資料1-2 カルベジロール 調査結果報告書及び添付文書[1.9MB] (42 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38855.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和5年度第15回 3/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
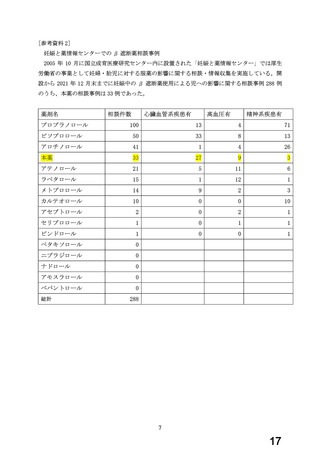
7.禁忌解除の妥当性
ワーキンググループにおいて、非臨床試験ならびに臨床における類薬を含めた使用例の妊娠転
帰に関する情報、本薬の妊娠に係るリスク情報として添付文書で注意喚起をすることを前提に、
以下の理由から、本薬の妊婦への投与については、
「禁忌」の項から削除し、
「9.5 妊婦」の項にお
いて「治療上の有益性が危険性を上回ると判断される場合にのみ投与する」旨の注意喚起を記載
することが適切であると判断した。
① 本薬は、現行妊婦に投与可能な β 遮断薬(αβ 遮断薬含む)にはない、
「虚血性心疾患又
は拡張型心筋症に基づく慢性心不全」の適応症を持っている。急性・慢性心不全診療ガイド
ライン(2017 年版)では、αβ 遮断薬のうち、複数の大規模臨床試験において生命予後改
善効果、死亡率の低下が示されている本薬が推奨されている。また、不整脈薬物治療ガイド
ライン(2020 年版)において、心拍数調節療法に用いられる内因性交感神経刺激作用 ISA の
ない β 遮断薬として、本薬が挙げられていること。
② 動物試験の結果から、本薬の生殖発生に及ぼす注意すべき毒性影響は、胚胎児死亡や出生児
死亡を示す致死作用と出生児の発育遅延であると考えられた。致死作用に対する無毒性量
は、ラット胎児では 60 mg/kg/日、ウサギ胎児で 15 mg/kg/日、ラット出生児で 60 mg/kg/
日であり、これらの用量は、国内の臨床使用状況に基づく MRHD(20 mg: 0.33 mg/kg/日)
のそれぞれ 29 倍、15 倍、29 倍に相当し(体表面積に基づくヒト相当量換算により算出)
、
生殖発生リスクの懸念が減少するといわれている 10 倍は確保されている。また、ラット出
生児の発育遅延に対する無毒性量は 12 mg/kg/日であり、この用量は MRHD の 6 倍のマージ
ンしか確保されていないが、この影響は母動物に対する過度の薬理作用に起因すると考えら
れることから、臨床使用時において母体及び胎児の状況を慎重に観察しながら管理すること
によりリスクを軽減することは可能であると考える。
なお、現行妊婦禁忌の設定理由に記載されているラット繁殖試験での黄体数の減少及び骨
格異常(13 肋骨の短小)の増加が認められた 300 mg/kg/日の用量は、国内の臨床使用状況に
基づく MRHD の 147 倍に相当する用量であり、臨床的な懸念は極めて小さいと考える。
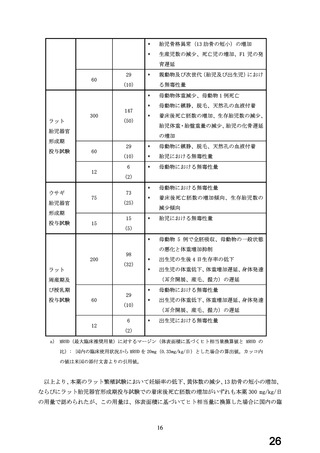
③ 海外(米国、英国、加国及び豪州)の添付文書においては、妊娠中の本薬の投与は禁忌とさ
れておらず、また、英国、加国及び豪州の添付文書では、潜在的利益が胎児への潜在的危険
性よりも大きい場合のみ投与すべきとされていること。
④ 妊娠第 1 三半期の曝露と児の先天異常発生に関する情報については、本薬 9 例を含む β 遮断
薬を妊娠初期に使用した母親の児 798 例の疫学研究(スウェーデン出生レジストリ(2)
)で
は、心奇形の発生率の上昇がみられたが、他の降圧薬においても同様の結果であった。薬剤
の内訳は不明であるが β 遮断薬を妊娠第 1 三半期に処方された母親の児 188 例(北米処方箋
データベース(3))の解析では、心奇形を含む先天異常の発生率の上昇とは関連がみられな
かった。また、4,847 例の β 遮断薬(このうち 3,357 例がラベタロール、本薬が含まれてい
るかは不明)を妊娠中に処方された例(カリフォルニア population-based cohort study、薬
局処方データで同定(4)
)の解析では、心奇形の発生率の上昇とは関連がみられなかった。
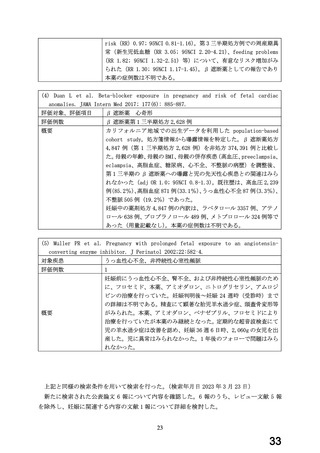
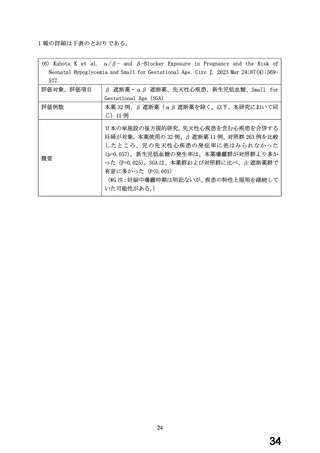
妊娠第 2 三半期以降の曝露と児への影響に関する情報については、国内研究(国内単施設
31
41
ワーキンググループにおいて、非臨床試験ならびに臨床における類薬を含めた使用例の妊娠転
帰に関する情報、本薬の妊娠に係るリスク情報として添付文書で注意喚起をすることを前提に、
以下の理由から、本薬の妊婦への投与については、
「禁忌」の項から削除し、
「9.5 妊婦」の項にお
いて「治療上の有益性が危険性を上回ると判断される場合にのみ投与する」旨の注意喚起を記載
することが適切であると判断した。
① 本薬は、現行妊婦に投与可能な β 遮断薬(αβ 遮断薬含む)にはない、
「虚血性心疾患又
は拡張型心筋症に基づく慢性心不全」の適応症を持っている。急性・慢性心不全診療ガイド
ライン(2017 年版)では、αβ 遮断薬のうち、複数の大規模臨床試験において生命予後改
善効果、死亡率の低下が示されている本薬が推奨されている。また、不整脈薬物治療ガイド
ライン(2020 年版)において、心拍数調節療法に用いられる内因性交感神経刺激作用 ISA の
ない β 遮断薬として、本薬が挙げられていること。
② 動物試験の結果から、本薬の生殖発生に及ぼす注意すべき毒性影響は、胚胎児死亡や出生児
死亡を示す致死作用と出生児の発育遅延であると考えられた。致死作用に対する無毒性量
は、ラット胎児では 60 mg/kg/日、ウサギ胎児で 15 mg/kg/日、ラット出生児で 60 mg/kg/
日であり、これらの用量は、国内の臨床使用状況に基づく MRHD(20 mg: 0.33 mg/kg/日)
のそれぞれ 29 倍、15 倍、29 倍に相当し(体表面積に基づくヒト相当量換算により算出)
、
生殖発生リスクの懸念が減少するといわれている 10 倍は確保されている。また、ラット出
生児の発育遅延に対する無毒性量は 12 mg/kg/日であり、この用量は MRHD の 6 倍のマージ
ンしか確保されていないが、この影響は母動物に対する過度の薬理作用に起因すると考えら
れることから、臨床使用時において母体及び胎児の状況を慎重に観察しながら管理すること
によりリスクを軽減することは可能であると考える。
なお、現行妊婦禁忌の設定理由に記載されているラット繁殖試験での黄体数の減少及び骨
格異常(13 肋骨の短小)の増加が認められた 300 mg/kg/日の用量は、国内の臨床使用状況に
基づく MRHD の 147 倍に相当する用量であり、臨床的な懸念は極めて小さいと考える。
③ 海外(米国、英国、加国及び豪州)の添付文書においては、妊娠中の本薬の投与は禁忌とさ
れておらず、また、英国、加国及び豪州の添付文書では、潜在的利益が胎児への潜在的危険
性よりも大きい場合のみ投与すべきとされていること。
④ 妊娠第 1 三半期の曝露と児の先天異常発生に関する情報については、本薬 9 例を含む β 遮断
薬を妊娠初期に使用した母親の児 798 例の疫学研究(スウェーデン出生レジストリ(2)
)で
は、心奇形の発生率の上昇がみられたが、他の降圧薬においても同様の結果であった。薬剤
の内訳は不明であるが β 遮断薬を妊娠第 1 三半期に処方された母親の児 188 例(北米処方箋
データベース(3))の解析では、心奇形を含む先天異常の発生率の上昇とは関連がみられな
かった。また、4,847 例の β 遮断薬(このうち 3,357 例がラベタロール、本薬が含まれてい
るかは不明)を妊娠中に処方された例(カリフォルニア population-based cohort study、薬
局処方データで同定(4)
)の解析では、心奇形の発生率の上昇とは関連がみられなかった。
妊娠第 2 三半期以降の曝露と児への影響に関する情報については、国内研究(国内単施設
31
41