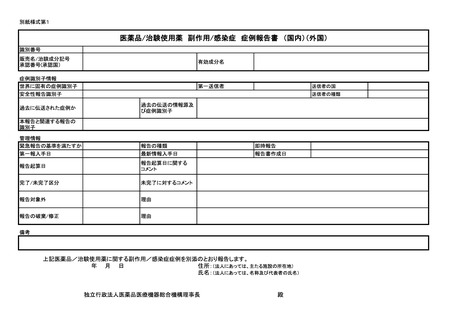
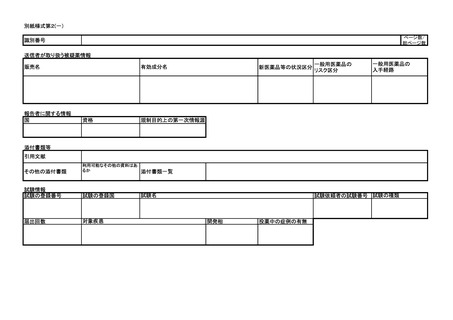
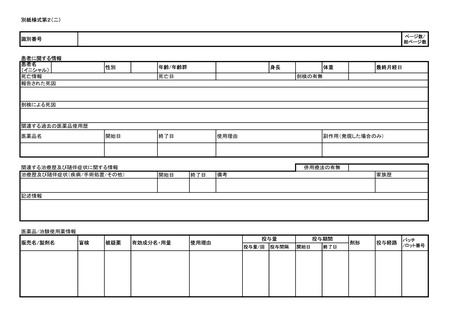
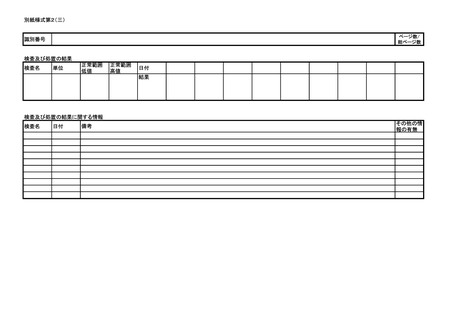
よむ、つかう、まなぶ。
「医薬品等の副作用等の報告について」の一部改正について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00010.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和3年度第2回 3/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
上の注意」の改訂等も含まれるものであること。
② 規則第 228 条の 20 第2項第2号関係
ア 「当該医療機器又は外国医療機器の不具合の発生であつて、当該不具合によつ
て死亡又は前号第1号ハ(1)から(5)までに掲げる症例等が発生するおそれ
があるもの」とは、医療機器の不具合の発生であって、現実には死亡、障害等は
発生していないが、死亡、障害等の発生し得ることが予想されるものであること。
イ 「がんその他の重大な疾病、障害若しくは死亡が発生するおそれがあること」
とは、疫学調査報告、動物等を用いた試験、物理的試験、化学的試験又は電気的
試験の成績等により、当該医療機器の不具合又はその使用による感染症に起因す
る重大な疾病の発現又はその可能性を示すものであること。
ウ 「当該医療機器若しくは外国医療機器の不具合による症例等若しくはそれらの
使用による感染症の発生傾向が著しく変化したこと」とは、当該医療機器若しく
は外国医療機器について、不具合による症例等若しくはそれらの使用による感染
症の発生数、発生頻度、発生条件、症状又は程度等の明らかな変化を示すもので
あること。
エ 「承認を受けた効能若しくは効果を有しないこと」とは、当該医療機器、当該
機器の形状・構造及び原理等又は品目仕様等について、臨床試験、動物試験等に
より、承認された効能又は効果を有しないことを示すものであること。
オ 「研究報告」とは、国内外の学術雑誌等に掲載された研究報告、自社又は関連
企業において行われた研究報告等を示すものであること。
③ 規則第 228 条の 20 第2項第3号関係
ア 「当該医療機器の不具合の発生のうち、当該不具合の発生によつて死亡及び第
1項第1号ハ(1)から(5)までに掲げる症例等以外の症例等が発生するおそ
れがあるもの」とは、当該医療機器の不具合の発生のうち、当該不具合により非
重篤な症例等が発生するおそれのあるものを示すものであること。
(3) コンビネーション医薬品について
① 規則第 228 条の 20 第3項関係
ア 「機械器具等と一体的に製造販売するものとして承認を受けた医薬品」とは、単
独で流通した場合には医療機器に該当することが想定される機械器具等と組み合
わせて製造販売するものとして承認を受けた医薬品(以下「コンビネーション医薬
品」という。)が該当すること。
イ 「当該医薬品の機械器具等に係る部分の不具合」とは、コンビネーション医薬品
の機械器具等において発生した不具合を指すこと。
(4) 再生医療等製品について
① 規則第 228 条の 20 第4項第1号関係
ア 「不具合による影響」とは、再生医療等製品の機能の不全、細胞が人体に及ぼす
② 規則第 228 条の 20 第2項第2号関係
ア 「当該医療機器又は外国医療機器の不具合の発生であつて、当該不具合によつ
て死亡又は前号第1号ハ(1)から(5)までに掲げる症例等が発生するおそれ
があるもの」とは、医療機器の不具合の発生であって、現実には死亡、障害等は
発生していないが、死亡、障害等の発生し得ることが予想されるものであること。
イ 「がんその他の重大な疾病、障害若しくは死亡が発生するおそれがあること」
とは、疫学調査報告、動物等を用いた試験、物理的試験、化学的試験又は電気的
試験の成績等により、当該医療機器の不具合又はその使用による感染症に起因す
る重大な疾病の発現又はその可能性を示すものであること。
ウ 「当該医療機器若しくは外国医療機器の不具合による症例等若しくはそれらの
使用による感染症の発生傾向が著しく変化したこと」とは、当該医療機器若しく
は外国医療機器について、不具合による症例等若しくはそれらの使用による感染
症の発生数、発生頻度、発生条件、症状又は程度等の明らかな変化を示すもので
あること。
エ 「承認を受けた効能若しくは効果を有しないこと」とは、当該医療機器、当該
機器の形状・構造及び原理等又は品目仕様等について、臨床試験、動物試験等に
より、承認された効能又は効果を有しないことを示すものであること。
オ 「研究報告」とは、国内外の学術雑誌等に掲載された研究報告、自社又は関連
企業において行われた研究報告等を示すものであること。
③ 規則第 228 条の 20 第2項第3号関係
ア 「当該医療機器の不具合の発生のうち、当該不具合の発生によつて死亡及び第
1項第1号ハ(1)から(5)までに掲げる症例等以外の症例等が発生するおそ
れがあるもの」とは、当該医療機器の不具合の発生のうち、当該不具合により非
重篤な症例等が発生するおそれのあるものを示すものであること。
(3) コンビネーション医薬品について
① 規則第 228 条の 20 第3項関係
ア 「機械器具等と一体的に製造販売するものとして承認を受けた医薬品」とは、単
独で流通した場合には医療機器に該当することが想定される機械器具等と組み合
わせて製造販売するものとして承認を受けた医薬品(以下「コンビネーション医薬
品」という。)が該当すること。
イ 「当該医薬品の機械器具等に係る部分の不具合」とは、コンビネーション医薬品
の機械器具等において発生した不具合を指すこと。
(4) 再生医療等製品について
① 規則第 228 条の 20 第4項第1号関係
ア 「不具合による影響」とは、再生医療等製品の機能の不全、細胞が人体に及ぼす