よむ、つかう、まなぶ。
「医薬品等の副作用等の報告について」の一部改正について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00010.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和3年度第2回 3/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(別添)
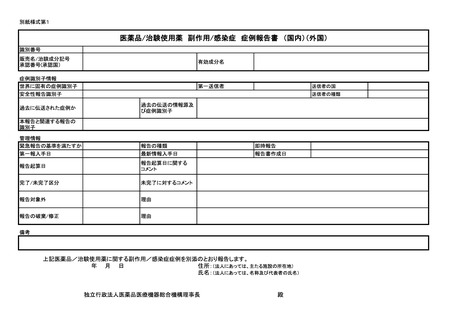
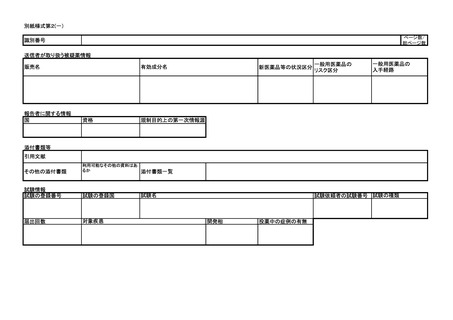
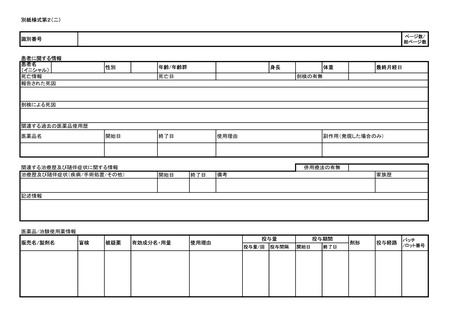
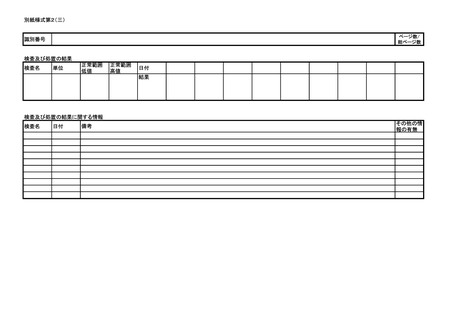
医薬品等の副作用等報告について
1
用語の解説
(1) 医薬品、医薬部外品及び化粧品について
① 規則第 228 条の 20 第1項第1号関係
ア 「死亡の発生のうち、当該医薬品の副作用によるものと疑われるもの」とは、
死亡した理由が、当該医薬品の副作用によるものと疑われる症例を指すものであ
ること。
イ 「副作用によるものと疑われるもの」とは、因果関係が否定できるもの以外の
ものを指し、因果関係が不明なものも含まれること。
ウ 「当該医薬品と成分が同一性を有すると認められる外国で使用されている医薬
品(以下「外国医薬品」という。)」とは、外国で使用されている物(治験中の物
を含む。)であって、当該医薬品と成分が同一のものを指し、投与経路、用法、用
量、効能、効果等が異なる場合も含まれるものであること。また、外国で発生し
た症例が報告対象となるか否かについては、規則第 228 条の 20 第1項第1号の規
定により判断すべきものであるが、少なくともその症例が発生した国においてそ
の国の政府に緊急に報告する必要がある症例については報告すべきものであるこ
と。
エ 「使用上の必要な注意等から予測することができないもの」とは、注意事項等
情報における「使用上の注意」(「警告」、「重要な基本的注意」、「相互作用」、「副
作用」等)に記載されていないもの、あるいは、記載されていてもその性質又は
症状の程度、特異性等が記載内容と一致しないもの(以下「未知」という。)であ
ること。例えば、副作用として「使用上の注意」に記載されていても、当該記載
では予測できないような重篤例は、15 日以内の報告の対象であること。
オ 「発生数、発生頻度、発生条件等の傾向(以下「発生傾向」という。)を当該医
薬品の使用上の必要な注意等から予測することができないもの」とは、当該医薬
品の副作用の発生数、発生頻度、発生条件等の傾向が、使用上の必要な注意等か
ら予測できないものを指すこと。例えば、
「使用上の注意」に記載のない医薬品と
の新たな相互作用により重篤な副作用や新たな副作用が発生した場合等が該当す
ること。
また、
「使用上の注意」に記載のある発生頻度に比べ、明らかに発生頻度が上昇
している場合等も該当する。
なお、発生頻度が予測できるか否か検討するために、定期的に出荷数、推定使
用患者数等を把握するか、又は少なくとも必要な時に当該データを入手できるよ
うに社内体制を整えておくことが望ましいこと。
カ 「発生傾向の変化が保健衛生上の危害の発生又は拡大のおそれを示すもの」と
医薬品等の副作用等報告について
1
用語の解説
(1) 医薬品、医薬部外品及び化粧品について
① 規則第 228 条の 20 第1項第1号関係
ア 「死亡の発生のうち、当該医薬品の副作用によるものと疑われるもの」とは、
死亡した理由が、当該医薬品の副作用によるものと疑われる症例を指すものであ
ること。
イ 「副作用によるものと疑われるもの」とは、因果関係が否定できるもの以外の
ものを指し、因果関係が不明なものも含まれること。
ウ 「当該医薬品と成分が同一性を有すると認められる外国で使用されている医薬
品(以下「外国医薬品」という。)」とは、外国で使用されている物(治験中の物
を含む。)であって、当該医薬品と成分が同一のものを指し、投与経路、用法、用
量、効能、効果等が異なる場合も含まれるものであること。また、外国で発生し
た症例が報告対象となるか否かについては、規則第 228 条の 20 第1項第1号の規
定により判断すべきものであるが、少なくともその症例が発生した国においてそ
の国の政府に緊急に報告する必要がある症例については報告すべきものであるこ
と。
エ 「使用上の必要な注意等から予測することができないもの」とは、注意事項等
情報における「使用上の注意」(「警告」、「重要な基本的注意」、「相互作用」、「副
作用」等)に記載されていないもの、あるいは、記載されていてもその性質又は
症状の程度、特異性等が記載内容と一致しないもの(以下「未知」という。)であ
ること。例えば、副作用として「使用上の注意」に記載されていても、当該記載
では予測できないような重篤例は、15 日以内の報告の対象であること。
オ 「発生数、発生頻度、発生条件等の傾向(以下「発生傾向」という。)を当該医
薬品の使用上の必要な注意等から予測することができないもの」とは、当該医薬
品の副作用の発生数、発生頻度、発生条件等の傾向が、使用上の必要な注意等か
ら予測できないものを指すこと。例えば、
「使用上の注意」に記載のない医薬品と
の新たな相互作用により重篤な副作用や新たな副作用が発生した場合等が該当す
ること。
また、
「使用上の注意」に記載のある発生頻度に比べ、明らかに発生頻度が上昇
している場合等も該当する。
なお、発生頻度が予測できるか否か検討するために、定期的に出荷数、推定使
用患者数等を把握するか、又は少なくとも必要な時に当該データを入手できるよ
うに社内体制を整えておくことが望ましいこと。
カ 「発生傾向の変化が保健衛生上の危害の発生又は拡大のおそれを示すもの」と