よむ、つかう、まなぶ。
「医薬品等の副作用等の報告について」の一部改正について (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00010.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和3年度第2回 3/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
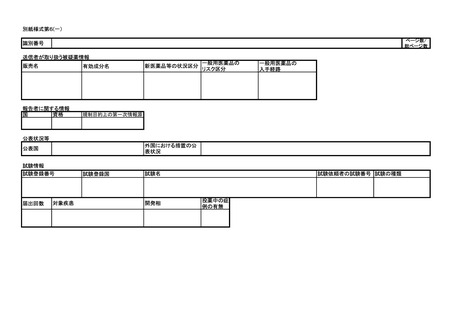
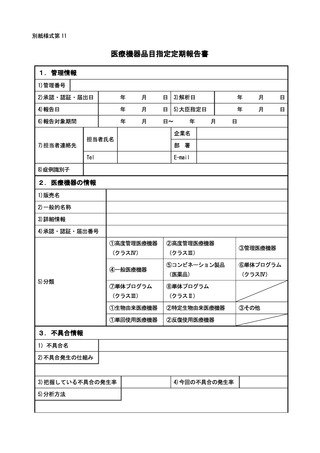
外国医療機器が製造、輸入、販売の中止等保健衛生上の危害の発生又は拡大を防
止するための措置が実施された場合については 15 日以内に報告すること。
当該医療機器若しくは外国医療機器の不具合若しくはそれらの使用による感染症
によりがんその他の重大な疾病、障害若しくは死亡が発生するおそれがあること、
当該医療機器若しくは外国医療機器の不具合による症例等若しくはそれらの使用に
よる感染症の発生傾向が著しく変化したこと又は当該医療機器が承認を受けた効能
若しくは効果を有しないことを示す研究報告を知った場合については、30 日以内に
報告すること。
さらに、報告期限内に報告すべき事項の調査が完了しない場合には、それまでに
得られた調査結果に、調査完了に時間を要する理由を添えて報告すること。
② 国内死亡症例、感染症報告についての全ての症例並びに外国医療機器に係る製造、
輸入又は販売の中止等保健衛生上の危害の発生又は拡大を防止するための措置が講
じられた場合の全ての措置内容について、独立行政法人医薬品医療機器総合機構医
療機器品質管理・安全対策部医療機器安全課に対し、ファックス等により速やかに
第一報の報告をすること。
③ 製造販売業者等は、医師等から報告を受けた場合のほか、医療機器販売業者等か
ら規則第 228 条の 20 第2項の症例の発生が疑われる旨の報告を受けた場合にも、速
やかに医師等に同条第2項に該当するか否かの判断を求めるよう努めること。
④ 規則第 228 条の 20 第2項第3号に規定する定期報告の報告起算日及び報告の頻度
については、当該医療機器の製造販売承認日、製造販売認証日又は製造販売届出日
から起算して、1年以内ごとに、その期間の満了後2月以内に行わなければならな
いこと。
(3)
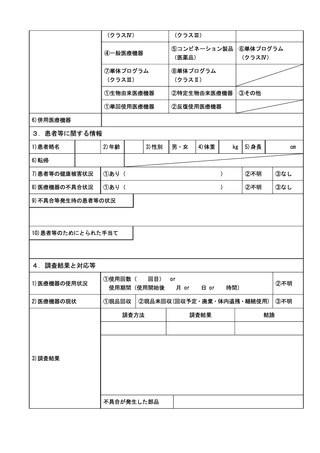
コンビネーション医薬品について
コンビネーション医薬品の機械器具等に係る部分の不具合の報告については、(2)の
医療機器の不具合報告に準拠すること。
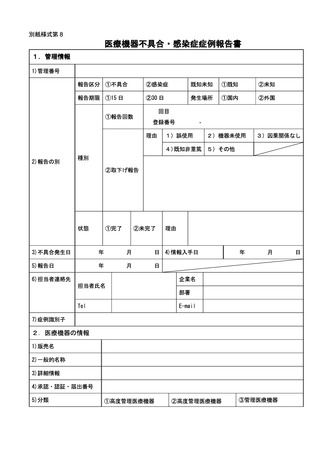
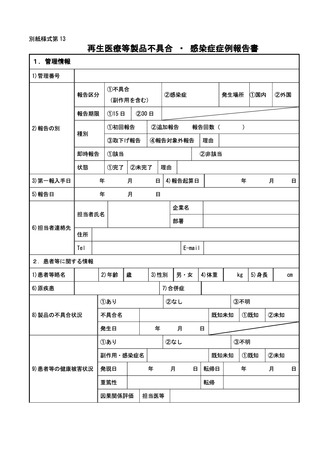
(4) 再生医療等製品について
① 再生医療等製品の不具合の報告は、規則第 228 条の 20 第4項第1号に該当する場
合は 15 日以内、同項第2号に該当する場合は 30 日以内に行うこと。
再生医療等製品の使用によるものと疑われる感染症の報告については、規則第 228
条の 20 第4項第1号に該当する場合は 15 日以内に行うこと。
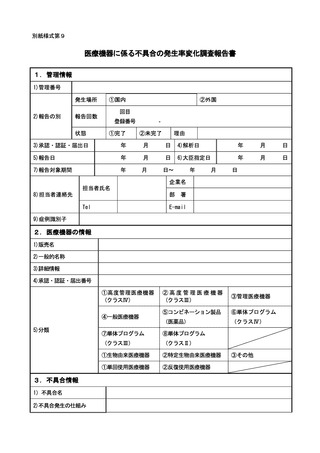
外国再生医療等製品が製造、輸入又は販売の中止等保健衛生上の危害の発生又は拡
大を防止するための措置が実施された場合については、15 日以内に報告すること。
当該再生医療等製品若しくは外国再生医療等製品の不具合若しくはそれらの使用
による感染症によりがんその他の重大な疾病、障害若しくは死亡が発生するおそれが
あること、当該再生医療等製品若しくは外国再生医療等製品の不具合による症例等若
しくはそれらの使用による感染症の発生傾向が著しく変化したこと又は当該再生医
療等製品が承認を受けた効能若しくは効果を有しないことを示す研究報告を知った
場合については 30 日以内に報告すること。
止するための措置が実施された場合については 15 日以内に報告すること。
当該医療機器若しくは外国医療機器の不具合若しくはそれらの使用による感染症
によりがんその他の重大な疾病、障害若しくは死亡が発生するおそれがあること、
当該医療機器若しくは外国医療機器の不具合による症例等若しくはそれらの使用に
よる感染症の発生傾向が著しく変化したこと又は当該医療機器が承認を受けた効能
若しくは効果を有しないことを示す研究報告を知った場合については、30 日以内に
報告すること。
さらに、報告期限内に報告すべき事項の調査が完了しない場合には、それまでに
得られた調査結果に、調査完了に時間を要する理由を添えて報告すること。
② 国内死亡症例、感染症報告についての全ての症例並びに外国医療機器に係る製造、
輸入又は販売の中止等保健衛生上の危害の発生又は拡大を防止するための措置が講
じられた場合の全ての措置内容について、独立行政法人医薬品医療機器総合機構医
療機器品質管理・安全対策部医療機器安全課に対し、ファックス等により速やかに
第一報の報告をすること。
③ 製造販売業者等は、医師等から報告を受けた場合のほか、医療機器販売業者等か
ら規則第 228 条の 20 第2項の症例の発生が疑われる旨の報告を受けた場合にも、速
やかに医師等に同条第2項に該当するか否かの判断を求めるよう努めること。
④ 規則第 228 条の 20 第2項第3号に規定する定期報告の報告起算日及び報告の頻度
については、当該医療機器の製造販売承認日、製造販売認証日又は製造販売届出日
から起算して、1年以内ごとに、その期間の満了後2月以内に行わなければならな
いこと。
(3)
コンビネーション医薬品について
コンビネーション医薬品の機械器具等に係る部分の不具合の報告については、(2)の
医療機器の不具合報告に準拠すること。
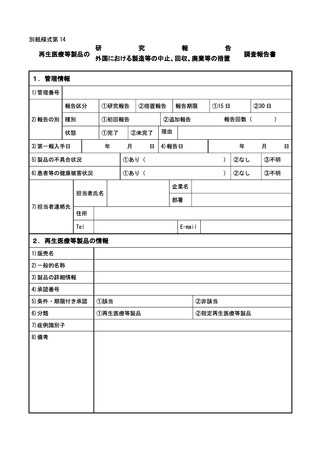
(4) 再生医療等製品について
① 再生医療等製品の不具合の報告は、規則第 228 条の 20 第4項第1号に該当する場
合は 15 日以内、同項第2号に該当する場合は 30 日以内に行うこと。
再生医療等製品の使用によるものと疑われる感染症の報告については、規則第 228
条の 20 第4項第1号に該当する場合は 15 日以内に行うこと。
外国再生医療等製品が製造、輸入又は販売の中止等保健衛生上の危害の発生又は拡
大を防止するための措置が実施された場合については、15 日以内に報告すること。
当該再生医療等製品若しくは外国再生医療等製品の不具合若しくはそれらの使用
による感染症によりがんその他の重大な疾病、障害若しくは死亡が発生するおそれが
あること、当該再生医療等製品若しくは外国再生医療等製品の不具合による症例等若
しくはそれらの使用による感染症の発生傾向が著しく変化したこと又は当該再生医
療等製品が承認を受けた効能若しくは効果を有しないことを示す研究報告を知った
場合については 30 日以内に報告すること。