よむ、つかう、まなぶ。
「医薬品等の副作用等の報告について」の一部改正について (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00010.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和3年度第2回 3/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
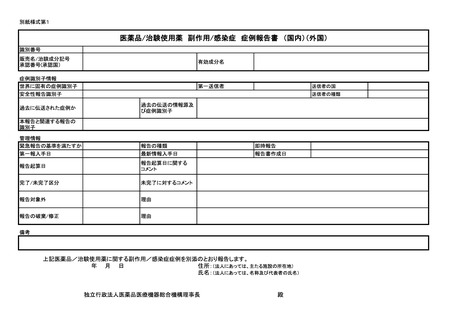
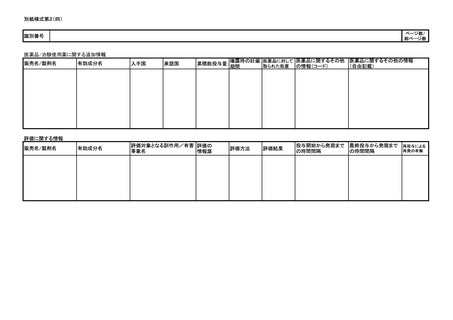
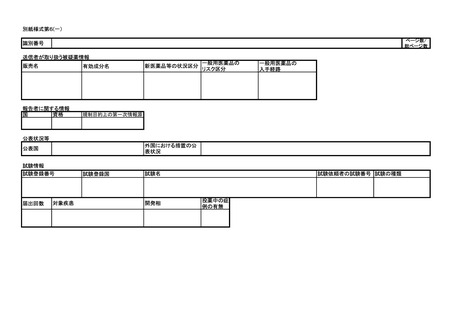
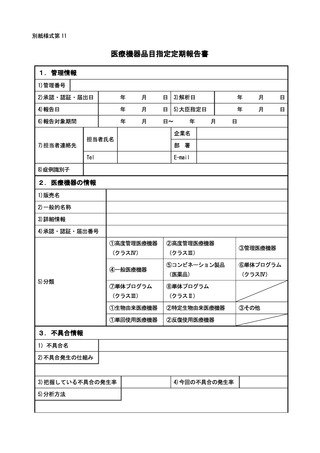
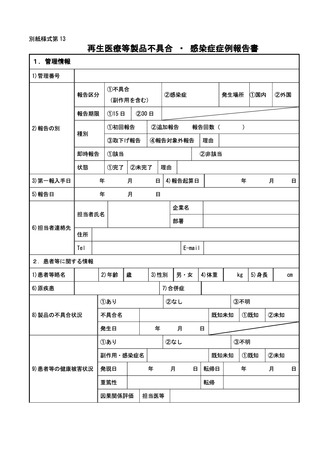
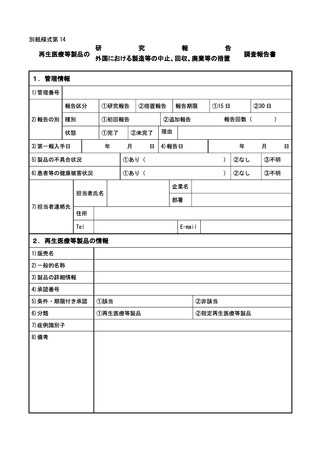
別紙様式第1
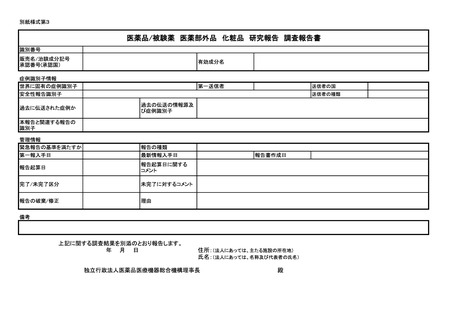
医薬品/治験使用薬 副作用/感染症 症例報告書 (国内)(外国)
識別番号
販売名/治験成分記号
承認番号(承認国)
有効成分名
症例識別子情報
世界に固有の症例識別子
安全性報告識別子
第一送信者
過去に伝送された症例か
送信者の国
送信者の種類
過去の伝送の情報源及
び症例識別子
本報告と関連する報告の
識別子
管理情報
緊急報告の基準を満たすか
第一報入手日
報告の種類
最新情報入手日
報告起算日
報告起算日に関する
コメント
完了/未完了区分
未完了に対するコメント
報告対象外
理由
報告の破棄/修正
理由
即時報告
報告書作成日
備考
上記医薬品/治験使用薬に関する副作用/感染症症例を別添のとおり報告します。
年 月 日
住所:(法人にあっては、主たる施設の所在地)
氏名:(法人にあっては、名称及び代表者の氏名)
独立行政法人医薬品医療機器総合機構理事長
殿
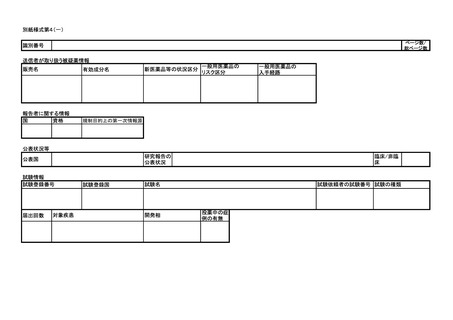
医薬品/治験使用薬 副作用/感染症 症例報告書 (国内)(外国)
識別番号
販売名/治験成分記号
承認番号(承認国)
有効成分名
症例識別子情報
世界に固有の症例識別子
安全性報告識別子
第一送信者
過去に伝送された症例か
送信者の国
送信者の種類
過去の伝送の情報源及
び症例識別子
本報告と関連する報告の
識別子
管理情報
緊急報告の基準を満たすか
第一報入手日
報告の種類
最新情報入手日
報告起算日
報告起算日に関する
コメント
完了/未完了区分
未完了に対するコメント
報告対象外
理由
報告の破棄/修正
理由
即時報告
報告書作成日
備考
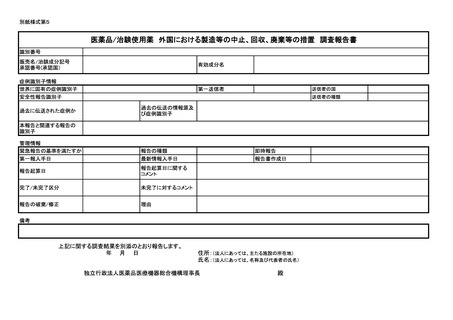
上記医薬品/治験使用薬に関する副作用/感染症症例を別添のとおり報告します。
年 月 日
住所:(法人にあっては、主たる施設の所在地)
氏名:(法人にあっては、名称及び代表者の氏名)
独立行政法人医薬品医療機器総合機構理事長
殿