よむ、つかう、まなぶ。
「医薬品等の副作用等の報告について」の一部改正について (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00010.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和3年度第2回 3/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
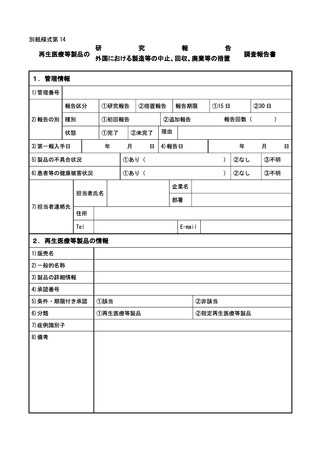
さらに、報告期限内に報告すべき事項の調査が完了しない場合には、それまでに得
られた調査結果に、調査完了に時間を要する理由を添えて報告すること。
② 国内死亡症例、感染症報告についての全ての症例並びに外国再生医療等製品に係
る製造、輸入又は販売の中止等保健衛生上の危害の発生又は拡大を防止するための
措置が講じられた場合の全ての措置内容について、独立行政法人医薬品医療機器総
合機構医薬品安全対策第二部に対し、ファックス等により速やかに第一報の報告を
すること。
③ 製造販売業者等は、医師等から報告を受けた場合のほか、再生医療等製品販売業
者等から規則第 228 条の 20 第4項の症例の発生が疑われる旨の報告を受けた場合に
も、速やかに医師等に同条第4項に該当するか否かの判断を求めるよう努めること。
④ 規則第 228 条の 20 第4項第3号に規定する定期報告の報告起算日及び報告の頻度
については、当該再生医療等製品の製造販売承認日又は国際誕生日等を報告起算日
とし、その日から起算して、1年以内ごとに、その期間の満了後2月以内に行わな
ければならないこと。
3
報告様式
(1) 医薬品、医薬部外品及び化粧品について
① 規則第 228 条の 20 第1項及び第5項の規定に基づく医薬品、医薬部外品及び化粧
品の副作用等に関する報告については、それぞれ以下の様式を用いて報告すること。
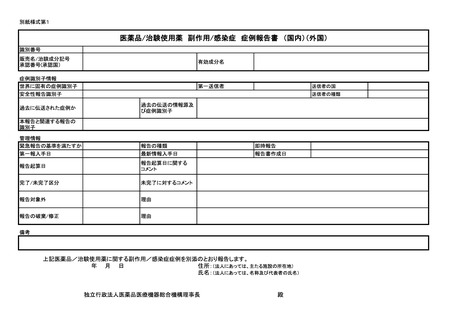
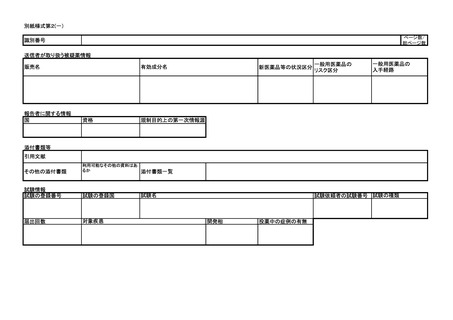
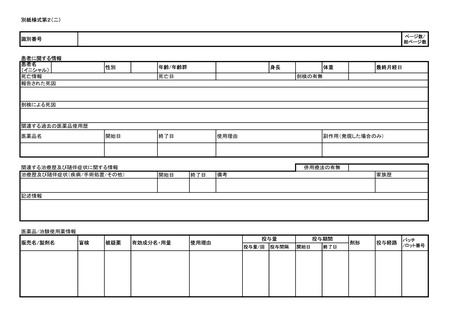
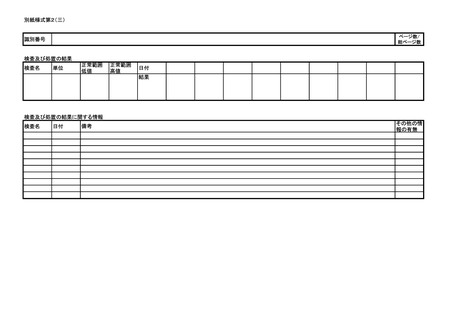
ア 同条第1項第1号イからトまで又は同項第2号イの規定に基づく報告について
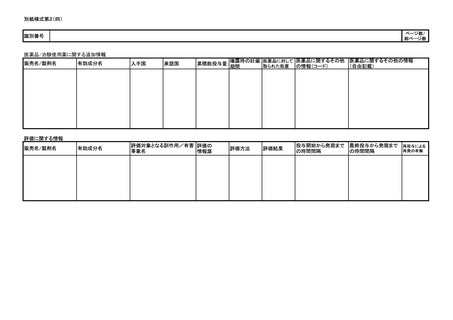
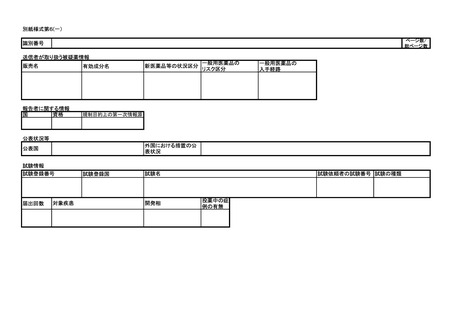
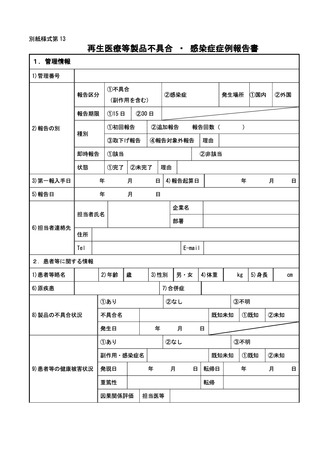
は別紙様式第1及び別紙様式第2(一)~(五)により報告を行うこと。
イ 同条第1項第2号ロ又は同条第5項第2号ロの規定に基づく報告については別
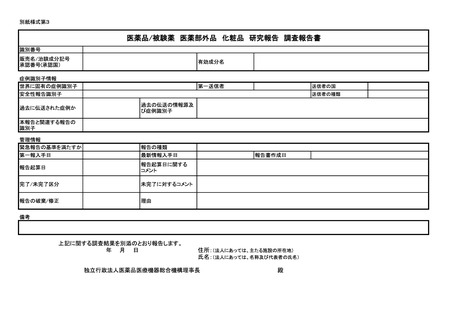
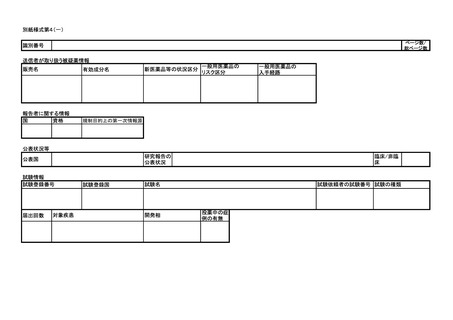
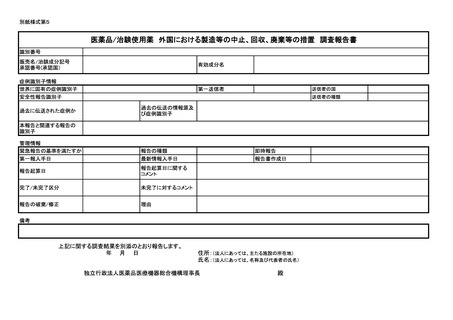
紙様式第3及び別紙様式第4により報告を行うこと。
ウ 同条第1項第1号チの規定に基づく報告については別紙様式第5及び別紙様式
第6により行うこと。
エ 同項第3号の規定に基づく報告については、別紙様式第7により報告を行うこと。
②規則第 228 条の 20 第1項(同項第3号を除く。)又は第5項の規定に基づく各別紙
様式による報告書については、前記各該当様式に掲げる事項を記録した CD-R(ROM)
等及び報告者の氏名、住所、報告の年月日その他必要事項を記載した書類をもって
これらの報告書に代えることができること。
第 228 条の 20 第1項(同項第3号を除く。)及び第5項第2号ロの規定に基づく報
告については、「厚生労働省の所管する法令に係る行政手続等における情報通信の技
術の利用に関する法律施行規則」(平成 15 年厚生労働省令第 40 号)に基づく電子情
報処理組織により報告することができること。
(2) 医療機器について
① 規則第 228 条の 20 第2項の規定に基づく医療機器の不具合等に関する報告につい
ては、それぞれ以下の様式を用いて報告すること。
ア 同項第1号イ、ロ、ハ、ホ、ト若しくはチ又は同項第2号イ若しくはロに基づ
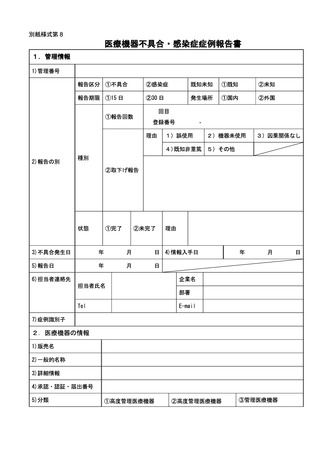
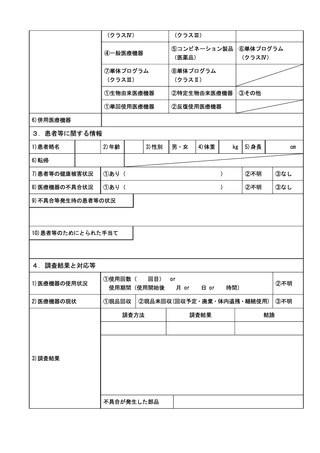
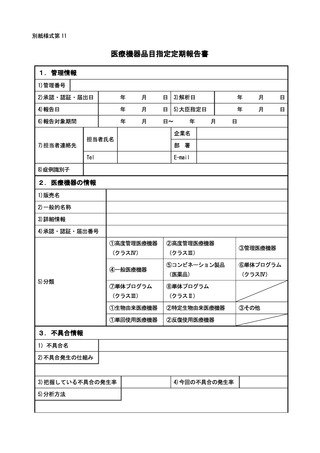
く報告については別紙様式第8により報告を行うこと。
られた調査結果に、調査完了に時間を要する理由を添えて報告すること。
② 国内死亡症例、感染症報告についての全ての症例並びに外国再生医療等製品に係
る製造、輸入又は販売の中止等保健衛生上の危害の発生又は拡大を防止するための
措置が講じられた場合の全ての措置内容について、独立行政法人医薬品医療機器総
合機構医薬品安全対策第二部に対し、ファックス等により速やかに第一報の報告を
すること。
③ 製造販売業者等は、医師等から報告を受けた場合のほか、再生医療等製品販売業
者等から規則第 228 条の 20 第4項の症例の発生が疑われる旨の報告を受けた場合に
も、速やかに医師等に同条第4項に該当するか否かの判断を求めるよう努めること。
④ 規則第 228 条の 20 第4項第3号に規定する定期報告の報告起算日及び報告の頻度
については、当該再生医療等製品の製造販売承認日又は国際誕生日等を報告起算日
とし、その日から起算して、1年以内ごとに、その期間の満了後2月以内に行わな
ければならないこと。
3
報告様式
(1) 医薬品、医薬部外品及び化粧品について
① 規則第 228 条の 20 第1項及び第5項の規定に基づく医薬品、医薬部外品及び化粧
品の副作用等に関する報告については、それぞれ以下の様式を用いて報告すること。
ア 同条第1項第1号イからトまで又は同項第2号イの規定に基づく報告について
は別紙様式第1及び別紙様式第2(一)~(五)により報告を行うこと。
イ 同条第1項第2号ロ又は同条第5項第2号ロの規定に基づく報告については別
紙様式第3及び別紙様式第4により報告を行うこと。
ウ 同条第1項第1号チの規定に基づく報告については別紙様式第5及び別紙様式
第6により行うこと。
エ 同項第3号の規定に基づく報告については、別紙様式第7により報告を行うこと。
②規則第 228 条の 20 第1項(同項第3号を除く。)又は第5項の規定に基づく各別紙
様式による報告書については、前記各該当様式に掲げる事項を記録した CD-R(ROM)
等及び報告者の氏名、住所、報告の年月日その他必要事項を記載した書類をもって
これらの報告書に代えることができること。
第 228 条の 20 第1項(同項第3号を除く。)及び第5項第2号ロの規定に基づく報
告については、「厚生労働省の所管する法令に係る行政手続等における情報通信の技
術の利用に関する法律施行規則」(平成 15 年厚生労働省令第 40 号)に基づく電子情
報処理組織により報告することができること。
(2) 医療機器について
① 規則第 228 条の 20 第2項の規定に基づく医療機器の不具合等に関する報告につい
ては、それぞれ以下の様式を用いて報告すること。
ア 同項第1号イ、ロ、ハ、ホ、ト若しくはチ又は同項第2号イ若しくはロに基づ
く報告については別紙様式第8により報告を行うこと。