よむ、つかう、まなぶ。
資料2-3 外国での新たな措置の報告状況 (50 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24331.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和3年度 第3回 3/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
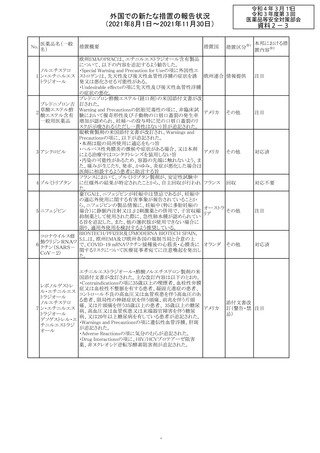
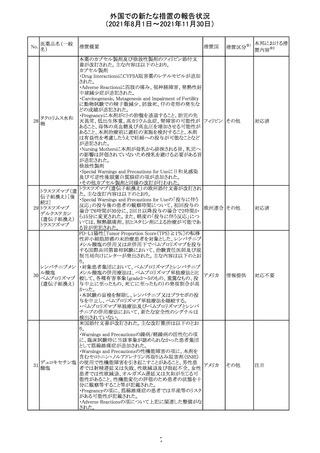
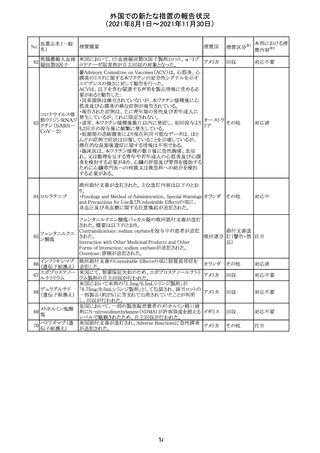
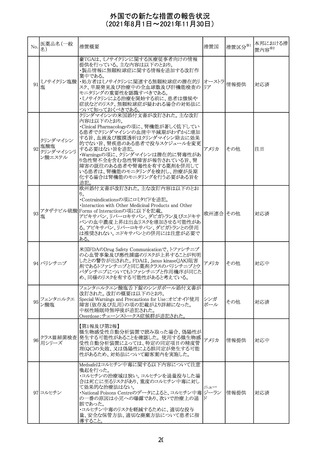
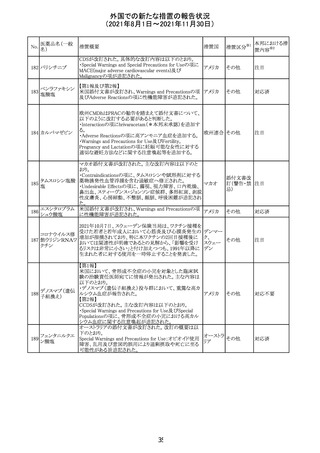
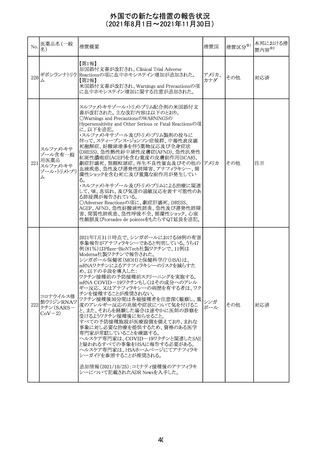
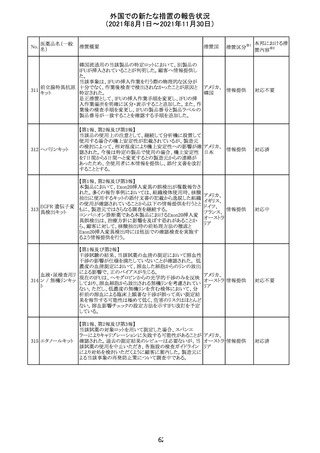
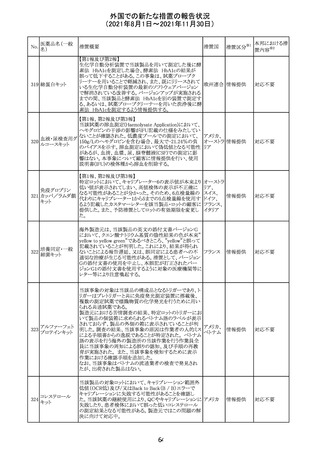
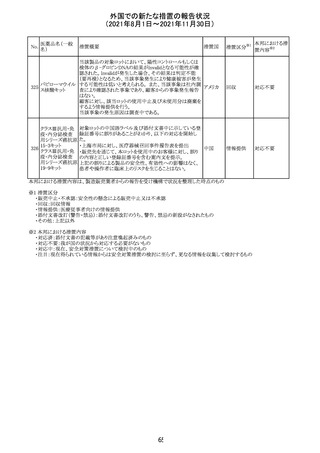
外国での新たな措置の報告状況
(2021年8月1日~2021年11月30日)
No.
医薬品名(一般
名)
措置概要
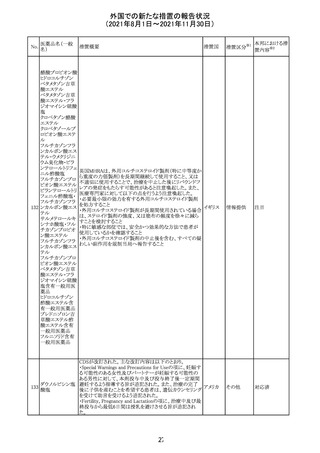
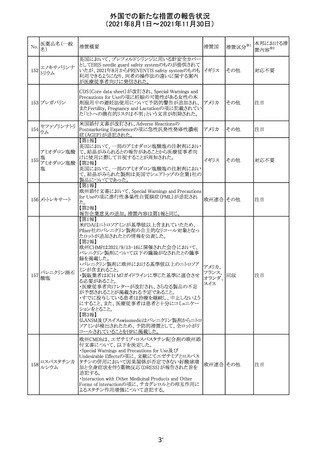
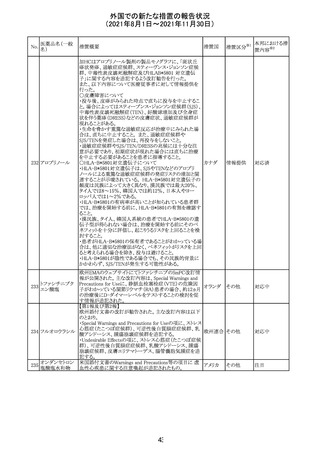
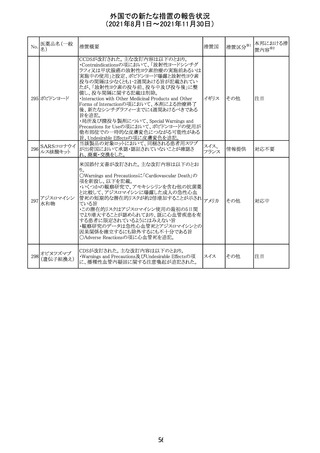
措置国
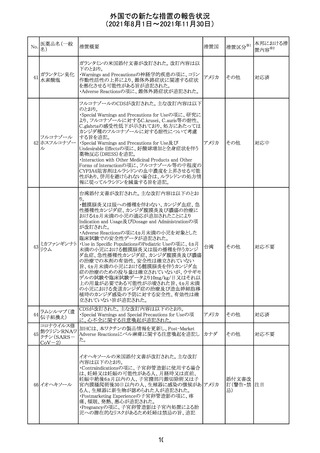
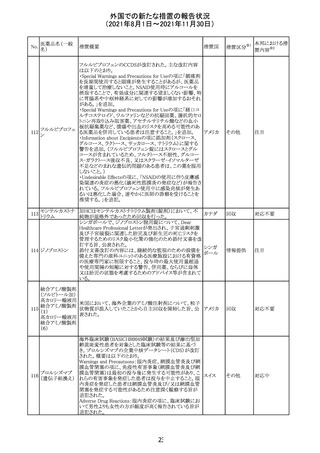
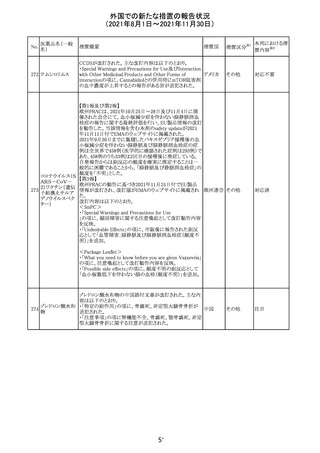
リンゲル液、乳酸リンゲル液、ブドウ糖加乳酸リンゲル液の
米国添付文書が改訂された。主な改訂内容は以下のとお
ネオスチグミンメ
り。
チル硫酸塩・無
・Contraindicationsの項に、新生児の血流中に致命的なセ
機塩類配合剤
フトリアキソンーカルシウム塩の沈殿が生じる可能性がある
塩化カリウム、塩
ため、別々の輸液ラインを使用していてもセフトリアキソンと
化ナトリウム含有
の併用をしている新生児(生後28日以下)は禁忌である
一般用医薬品
旨、追記された。
乳酸リンゲル液
・Warnings and PrecautionsのDrug Interactionsの項に、本
266 乳酸リンゲル液
アメリカ
剤とセフトリアキソンが同じ静脈内投与ラインで混合すると
(マルトース加)
セフトリアキソン-カルシウムの沈殿が起こる可能性がある
乳酸リンゲル液
旨、新生児以外の患者では、輸液ラインを十分に洗浄すれ
(ソルビトール加)
ばセフトリアキソンと乳酸リンゲル液を順次投与することが
リンゲル液
可能である。しかし、新生児では別々の輸液ラインを使用し
酢酸リンゲル液
た場合でも肺や腎臓に沈殿物が生じ、死亡例が発生して
(ブドウ糖加)
いる旨、追記された。
酢酸リンゲル液
・Pediatric Useの項、セフトリアキソンによる沈殿の項に、上
記の内容が追記された。
措置区分
※1
添付文書改
訂(警告・禁 対応中
忌)
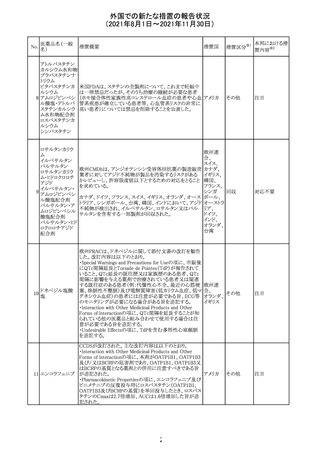
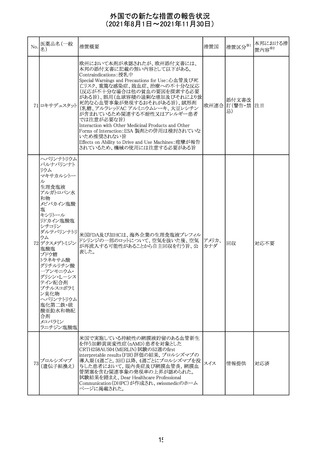
インスリン アスパ オーストラリアにおいて、一部のインスリン製剤の患者向け
オーストラ
267 ルト(遺伝子組換 医療情報に誤記があることが判明し、回収措置が取られ
回収
リア
え
た。
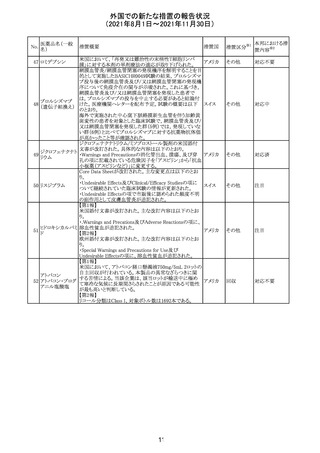
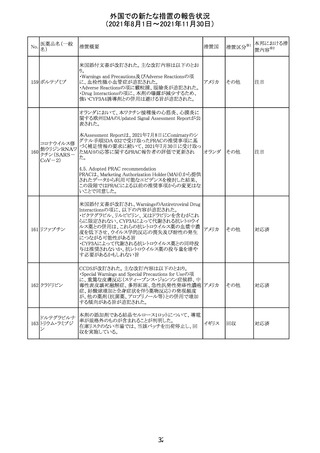
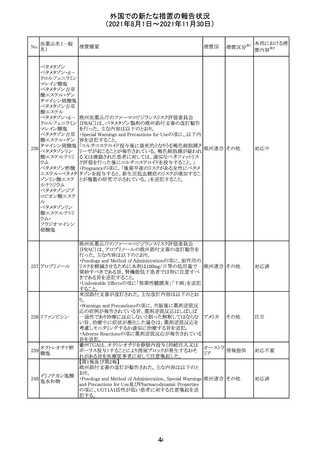
米国FDAにて、サラゾスルファピリジン含有製剤について、
以下のとおり、添付文書が改訂された。
Warnings and Precautionsの[Other Severe Cutaneous
Adverse Reactions] にて、急性汎発性発疹性膿疱症
サラゾスルファピ (AGEP)が追記された。
268
アメリカ その他
リジン
また、上記改訂に伴い、Postmarketing Reportsにおいても
同様に更新された。
なお、Warnings and Precautionsにおいて、関連項目ごとに
パラグラフを改編し、サブタイトルを追記する等、記載整備
が行われた。
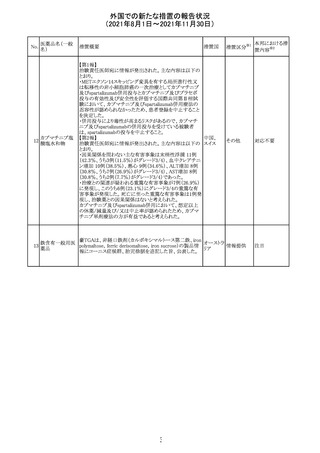
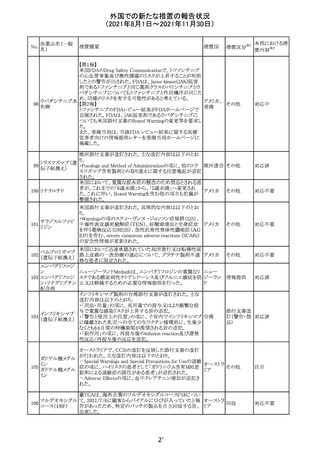
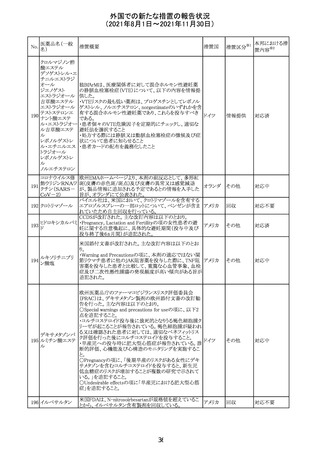
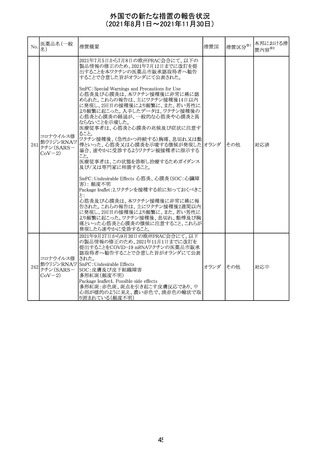
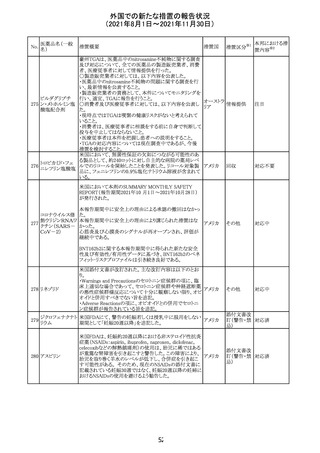
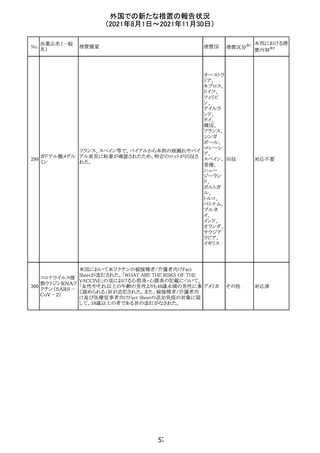
Direct Healthcare Professional Communicationが更新され
た。DHPCの概要は以下のとおり。
・網膜血管炎,網膜血管閉塞を含む眼内炎症は,ブロルシ
ズマブの初回の硝子体内注射後及び治療のいかなる時期
でも生じ得る。これらの事象は治療の早期に頻繁に観察さ
れている。
・治療中に抗ブロルシズマブ抗体を生じた患者では,より多
くの眼内炎症の事象がみられている。
・網膜血管炎,網膜血管閉塞を含む眼内炎症を生じた患
者では治療を中止し,発現した事象に対し速やかに管理を
ブロルシズマブ 行うこと。
269
オランダ 情報提供
(遺伝子組換え) ・本剤維持期(最初の3回の投与以降)の投与では,8週間
未満の間隔で投与しないこと。
・本剤治療の前の年に眼内炎症や網膜血管閉塞の病歴が
ある患者では,網膜血管炎,網膜血管閉塞を発症するリス
クが高いため,注意深く観察すること。
・女性が追加のリスクファクターであることが特定された。ま
た,日本人患者において,高い発生率がみられた。
・眼内炎症、網膜血管炎及び網膜血管閉塞の初期徴候及
び症状を認識する方法を患者に指導し,これらの副作用が
疑われる場合は直ちに医療機関を受診するよう患者を指
導すること。
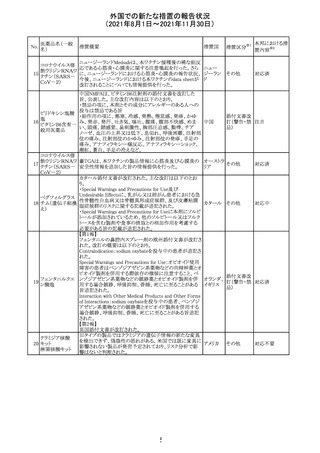
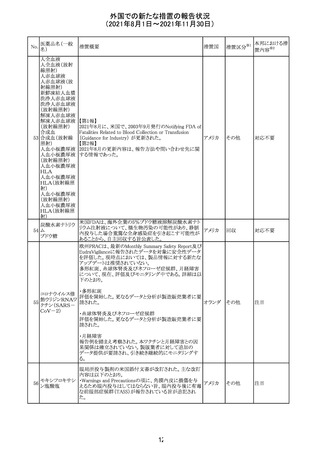
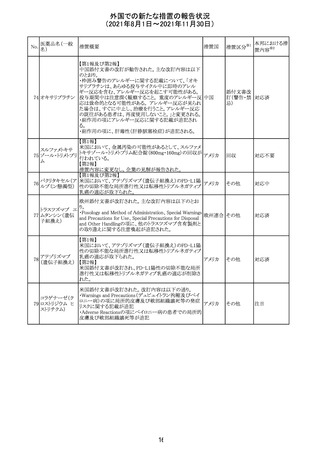
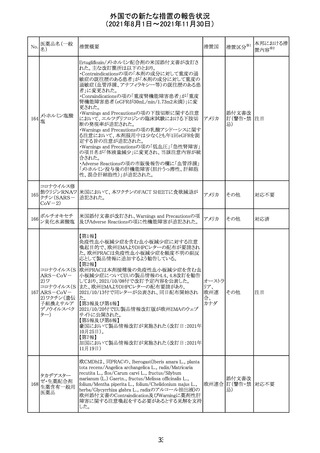
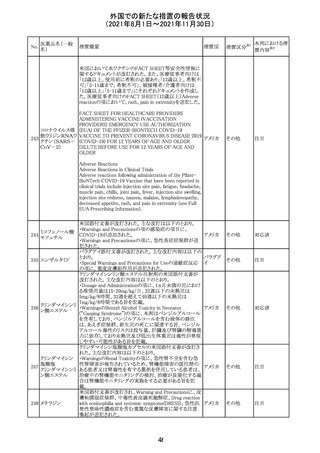
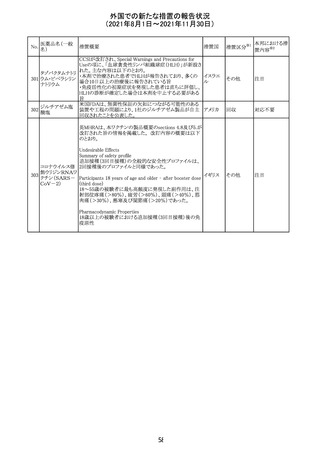
【第1報及び第2報】
シンガポール添付文書が改訂された。主な改訂内容は以
シンガ
270 エンザルタミド
下のとおり。
その他
ポール
・Undesirable Effectsの項に、重度皮膚副作用が追記され
た。
イソクスプリン塩 米国FDAは、有効性欠如を理由にイソクスプリン塩酸塩を
販売中止・
271
アメリカ
酸塩
販売中止した。
不承認
50
本邦における措
※2
置内容
対応不要
注目
対応中
注目
注目
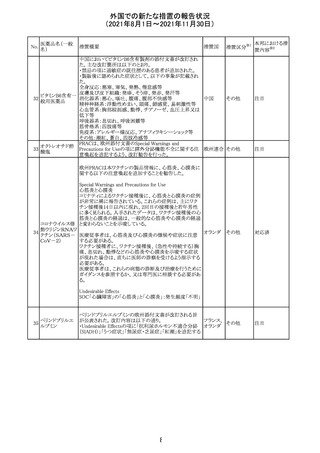
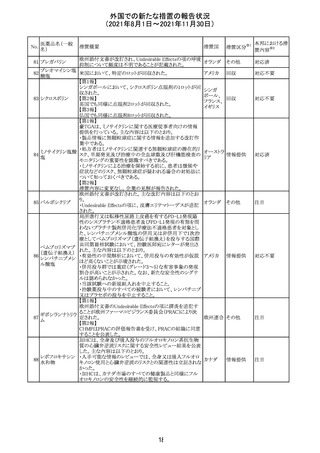
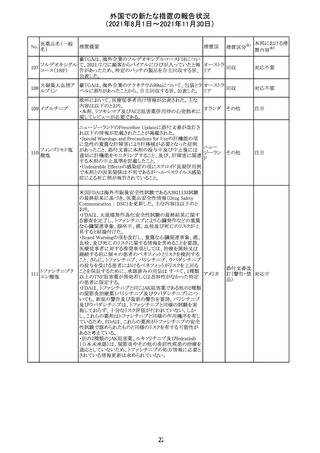
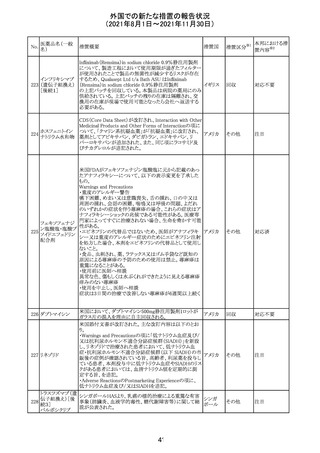
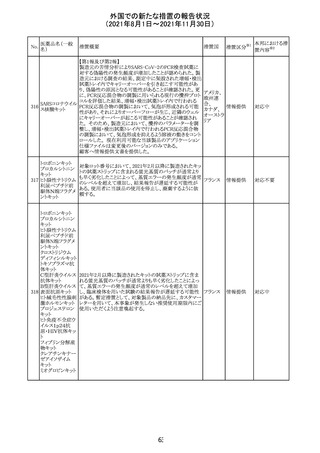
(2021年8月1日~2021年11月30日)
No.
医薬品名(一般
名)
措置概要
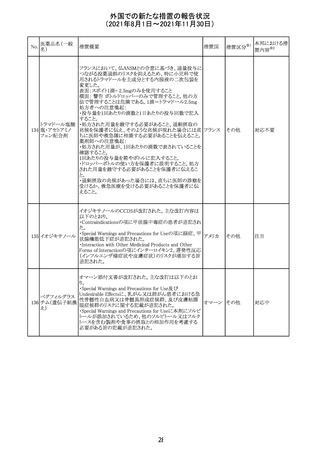
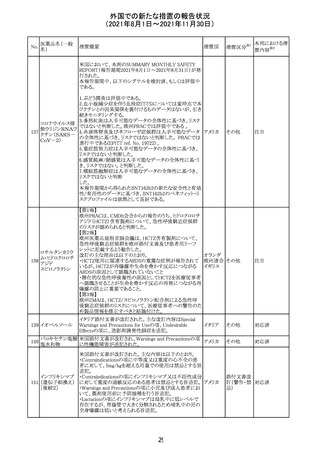
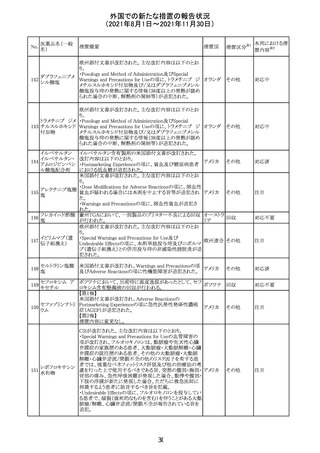
措置国
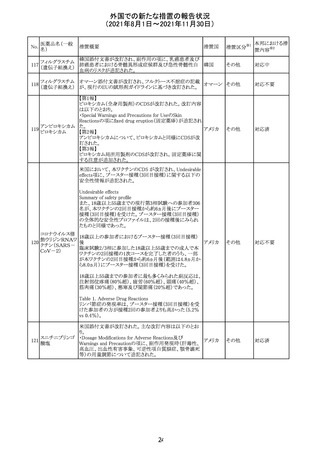
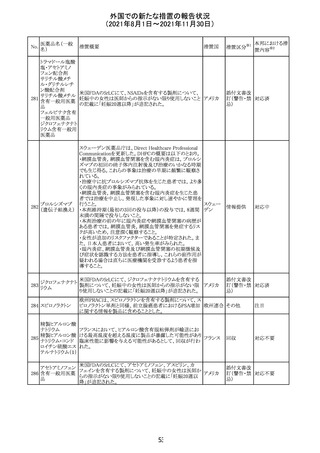
リンゲル液、乳酸リンゲル液、ブドウ糖加乳酸リンゲル液の
米国添付文書が改訂された。主な改訂内容は以下のとお
ネオスチグミンメ
り。
チル硫酸塩・無
・Contraindicationsの項に、新生児の血流中に致命的なセ
機塩類配合剤
フトリアキソンーカルシウム塩の沈殿が生じる可能性がある
塩化カリウム、塩
ため、別々の輸液ラインを使用していてもセフトリアキソンと
化ナトリウム含有
の併用をしている新生児(生後28日以下)は禁忌である
一般用医薬品
旨、追記された。
乳酸リンゲル液
・Warnings and PrecautionsのDrug Interactionsの項に、本
266 乳酸リンゲル液
アメリカ
剤とセフトリアキソンが同じ静脈内投与ラインで混合すると
(マルトース加)
セフトリアキソン-カルシウムの沈殿が起こる可能性がある
乳酸リンゲル液
旨、新生児以外の患者では、輸液ラインを十分に洗浄すれ
(ソルビトール加)
ばセフトリアキソンと乳酸リンゲル液を順次投与することが
リンゲル液
可能である。しかし、新生児では別々の輸液ラインを使用し
酢酸リンゲル液
た場合でも肺や腎臓に沈殿物が生じ、死亡例が発生して
(ブドウ糖加)
いる旨、追記された。
酢酸リンゲル液
・Pediatric Useの項、セフトリアキソンによる沈殿の項に、上
記の内容が追記された。
措置区分
※1
添付文書改
訂(警告・禁 対応中
忌)
インスリン アスパ オーストラリアにおいて、一部のインスリン製剤の患者向け
オーストラ
267 ルト(遺伝子組換 医療情報に誤記があることが判明し、回収措置が取られ
回収
リア
え
た。
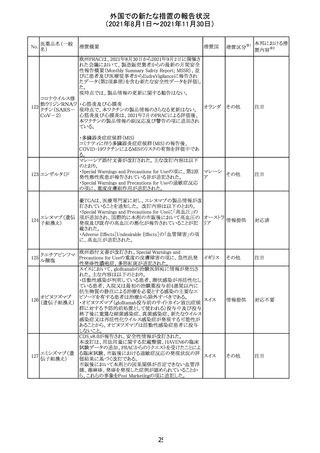
米国FDAにて、サラゾスルファピリジン含有製剤について、
以下のとおり、添付文書が改訂された。
Warnings and Precautionsの[Other Severe Cutaneous
Adverse Reactions] にて、急性汎発性発疹性膿疱症
サラゾスルファピ (AGEP)が追記された。
268
アメリカ その他
リジン
また、上記改訂に伴い、Postmarketing Reportsにおいても
同様に更新された。
なお、Warnings and Precautionsにおいて、関連項目ごとに
パラグラフを改編し、サブタイトルを追記する等、記載整備
が行われた。
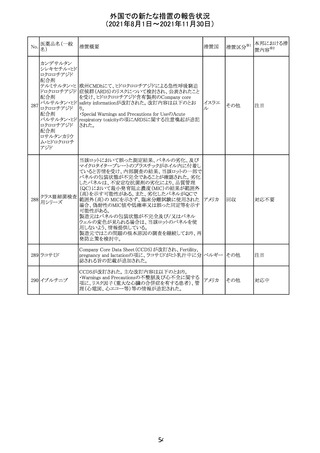
Direct Healthcare Professional Communicationが更新され
た。DHPCの概要は以下のとおり。
・網膜血管炎,網膜血管閉塞を含む眼内炎症は,ブロルシ
ズマブの初回の硝子体内注射後及び治療のいかなる時期
でも生じ得る。これらの事象は治療の早期に頻繁に観察さ
れている。
・治療中に抗ブロルシズマブ抗体を生じた患者では,より多
くの眼内炎症の事象がみられている。
・網膜血管炎,網膜血管閉塞を含む眼内炎症を生じた患
者では治療を中止し,発現した事象に対し速やかに管理を
ブロルシズマブ 行うこと。
269
オランダ 情報提供
(遺伝子組換え) ・本剤維持期(最初の3回の投与以降)の投与では,8週間
未満の間隔で投与しないこと。
・本剤治療の前の年に眼内炎症や網膜血管閉塞の病歴が
ある患者では,網膜血管炎,網膜血管閉塞を発症するリス
クが高いため,注意深く観察すること。
・女性が追加のリスクファクターであることが特定された。ま
た,日本人患者において,高い発生率がみられた。
・眼内炎症、網膜血管炎及び網膜血管閉塞の初期徴候及
び症状を認識する方法を患者に指導し,これらの副作用が
疑われる場合は直ちに医療機関を受診するよう患者を指
導すること。
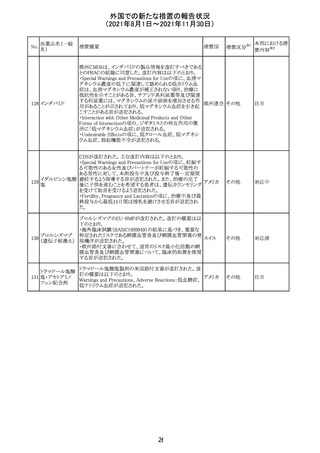
【第1報及び第2報】
シンガポール添付文書が改訂された。主な改訂内容は以
シンガ
270 エンザルタミド
下のとおり。
その他
ポール
・Undesirable Effectsの項に、重度皮膚副作用が追記され
た。
イソクスプリン塩 米国FDAは、有効性欠如を理由にイソクスプリン塩酸塩を
販売中止・
271
アメリカ
酸塩
販売中止した。
不承認
50
本邦における措
※2
置内容
対応不要
注目
対応中
注目
注目