よむ、つかう、まなぶ。
資料2-3 外国での新たな措置の報告状況 (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24331.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和3年度 第3回 3/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
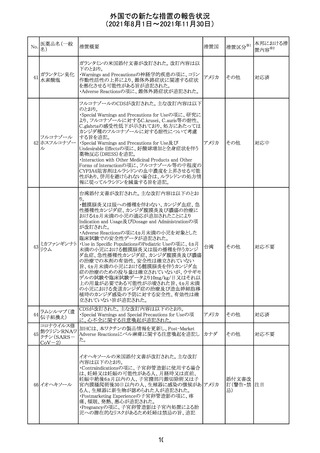
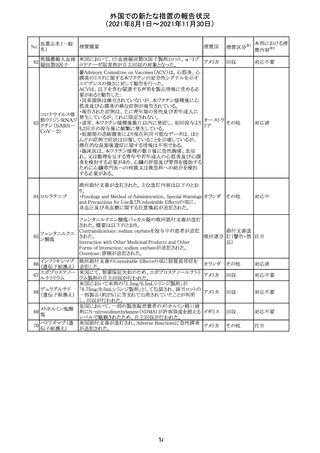
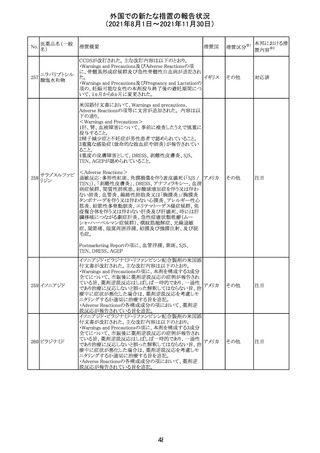
外国での新たな措置の報告状況
(2021年8月1日~2021年11月30日)
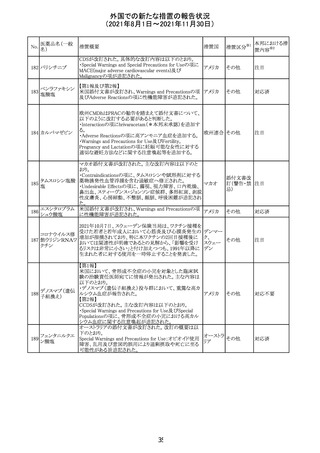
No.
医薬品名(一般
名)
措置概要
措置国
措置区分
※1
本邦における措
※2
置内容
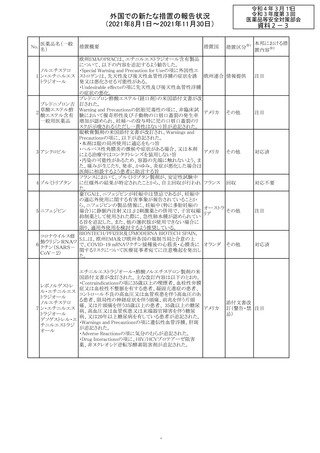
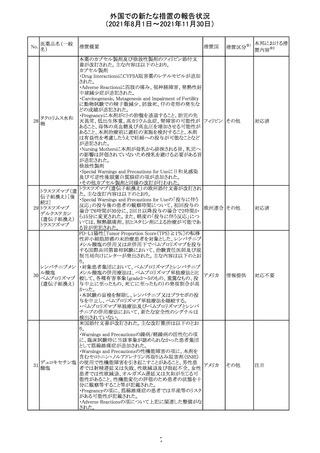
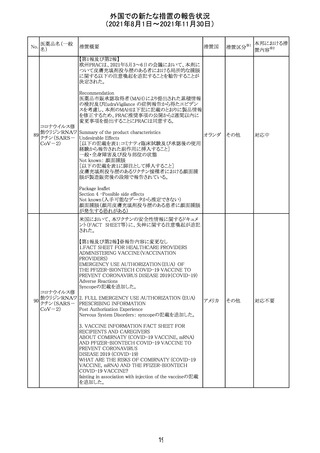
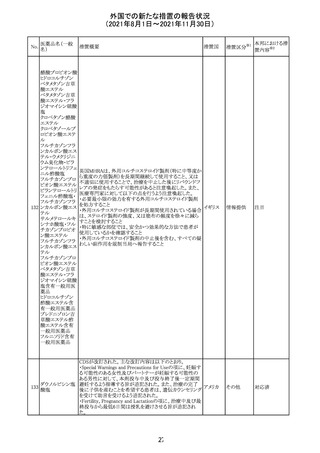
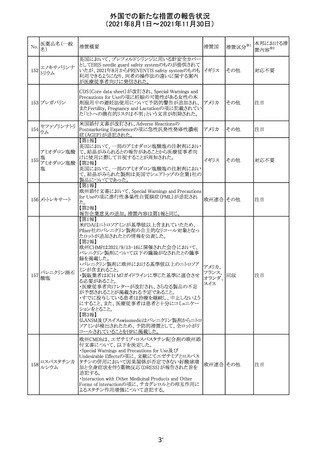
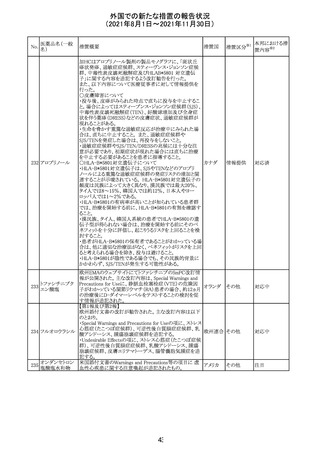
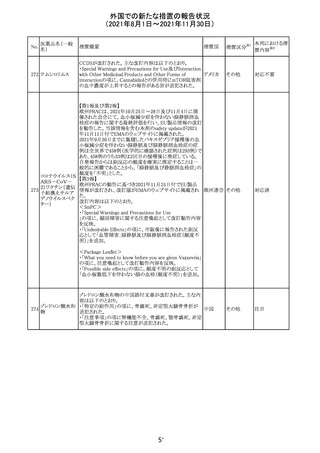
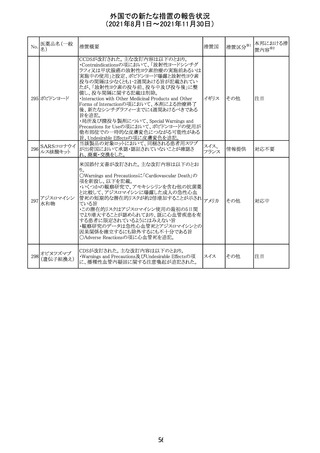
欧州PRACは、2021年8月30日から2021年9月2日に開催さ
れた会議において、製造販売業者からの最新の月間安全
性報告概要(Monthly Summary Safety Report; MSSR)、並
びに患者及び医療従事者からEudraVigilanceに報告され
たデータ(第2項参照)を含む新たな安全性データを評価し
た。
現時点では、製品情報の更新に関する勧告はない。
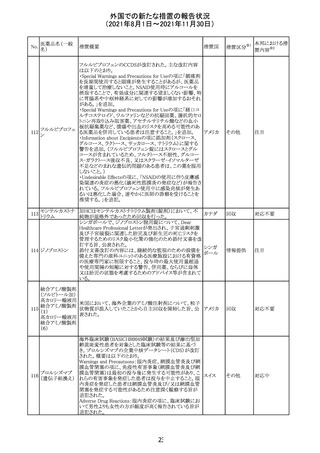
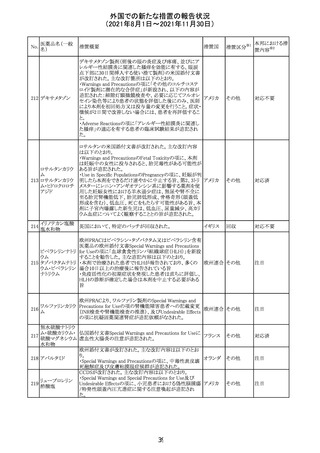
コロナウイルス修
飾ウリジンRNAワ ・心筋炎及び心膜炎
122
オランダ その他
クチン(SARS- 現時点で、本ワクチンの製品情報のさらなる更新はない。
CoV-2)
心筋炎及び心膜炎は、2021年7月のPRACによる評価後、
本ワクチンの製品情報の副反応及び警告の項に追加され
ている。
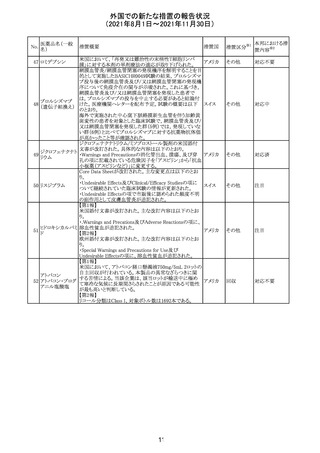
123 エンザルタミド
・多臓器炎症症候群(MIS)
コミナティに伴う多臓器炎症症候群(MIS)の報告後、
COVID-19ワクチンによるMISのリスクの有無を評価中であ
る。
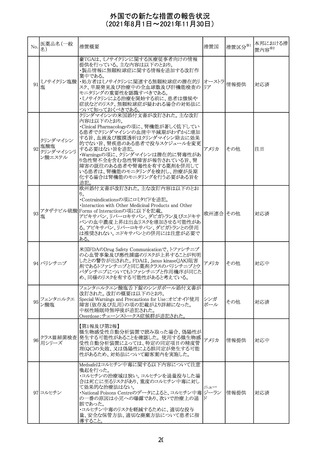
マレーシア添付文書が改訂された。主な改訂内容は以下
のとおり。
・Special Warnings and Precautions for Useの項に、第2原 マレーシ
その他
発性悪性疾患が報告されている旨が追記された。
ア
・Special Warnings and Precautions for Useの過敏症反応
の項に、重度皮膚副作用が追記された。
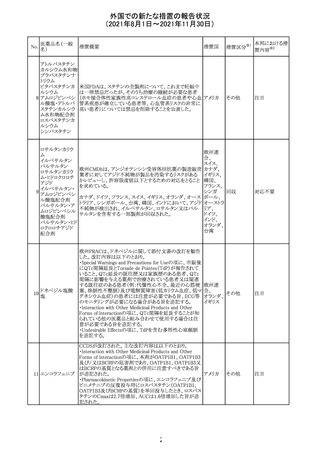
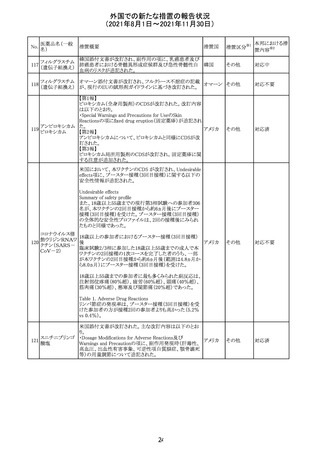
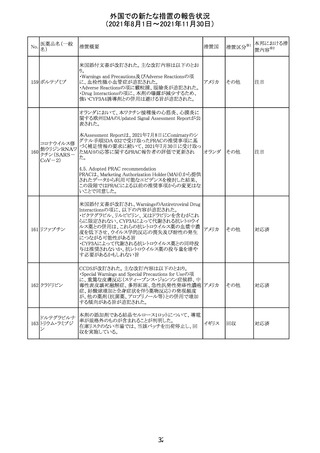
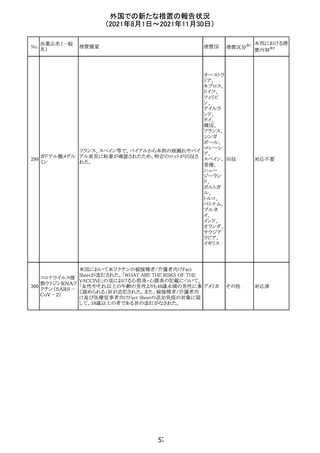
豪TGAは、医療専門家に対し、エレヌマブの製品情報が改
訂されていることを通知した。 改訂内容は以下のとおり。
・Special Warnings and Precautions for Useに「高血圧」の
エレヌマブ(遺伝 項が追加され、国際的に本剤の市販後において高血圧の オーストラ
124
情報提供
子組換え)
発現及び既存の高血圧の悪化が報告されていることが記 リア
載された。
・Adverse Effects[Undesirable Effects]の「血管障害」の項
に、高血圧が追記された。
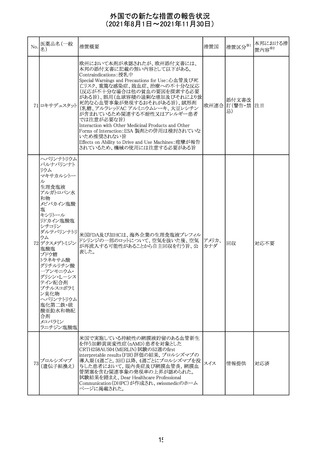
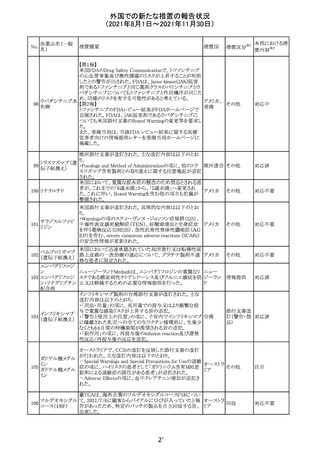
欧州添付文書が改訂され、Special Warnings and
クエチアピンフマ
Precautions for Useの重度の皮膚障害の項に、急性汎発 イギリス
ル酸塩
性発疹性膿疱症、多形紅斑が追記された。
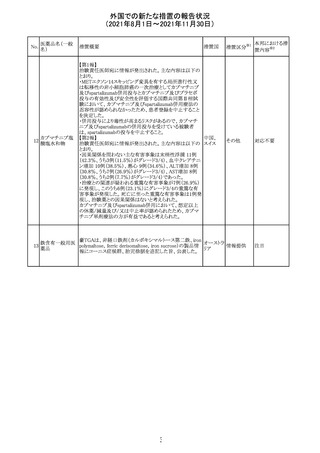
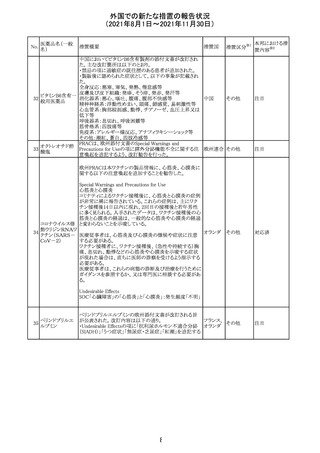
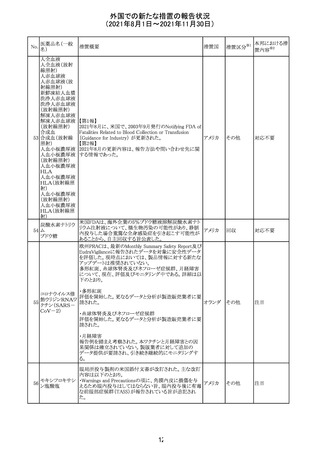
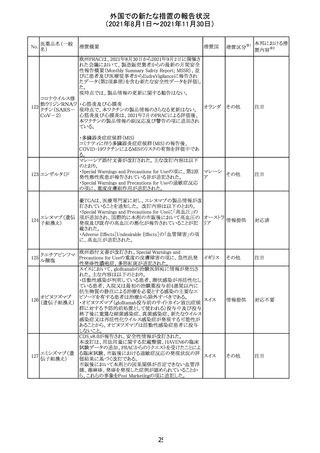
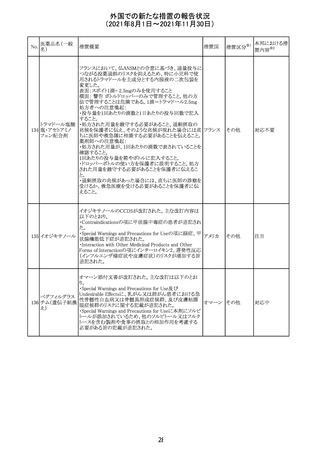
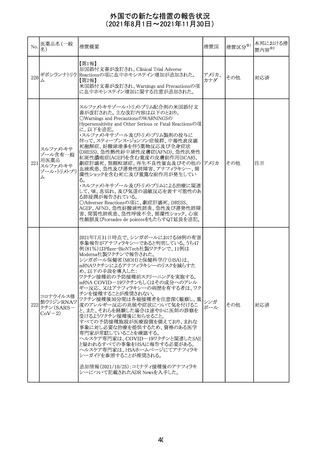
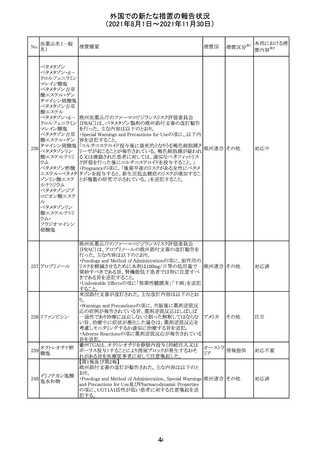
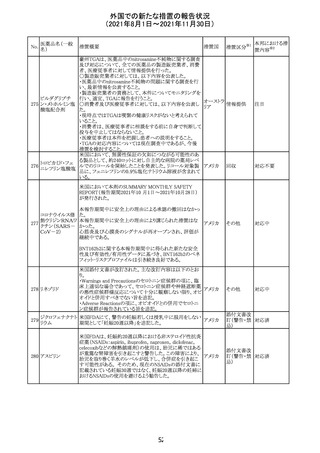
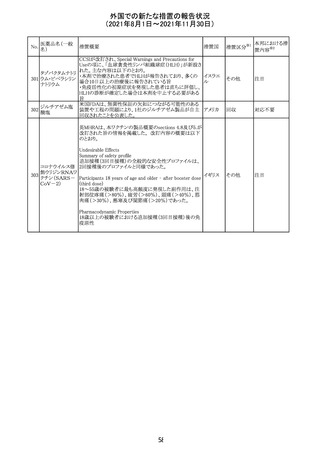
スイスにおいて、glofitamabの治験医師宛に情報が発出さ
れた。主な内容は以下のとおり。
・活動性感染が判明している患者、潜伏感染が再活性化し
ている患者、入院又は最初の治験薬投与前4週間以内に
抗生物質の静注による治療を必要とする感染の主要なエ
オビヌツズマブ
ピソードを有する患者は治療から除外すべきである。
126
スイス
(遺伝子組換え) ・オビヌツズマブ(glofitamab投与前のサイトカイン放出症候
群に対する予防的前処置として使われる)投与中及び投与
終了後に重篤な細菌感染症、真菌感染症、新たなウイルス
感染症又は再活性化ウイルス感染症が発現する可能性が
あることから、オビヌツズマブは活動性感染症患者に投与
しないこと。
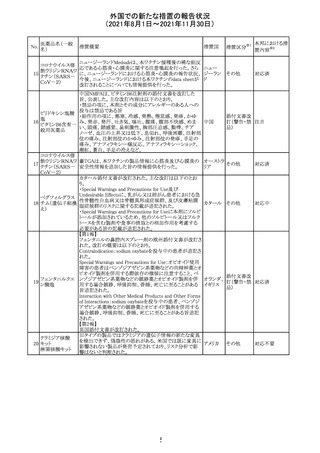
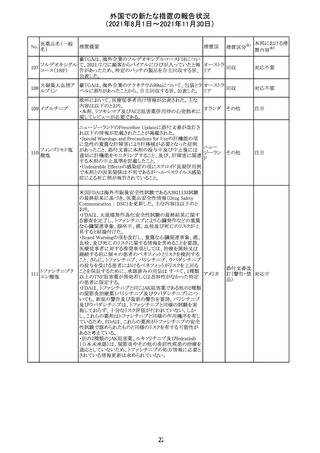
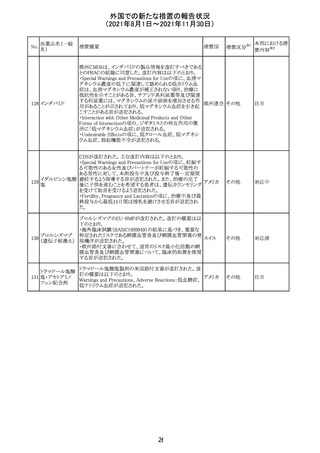
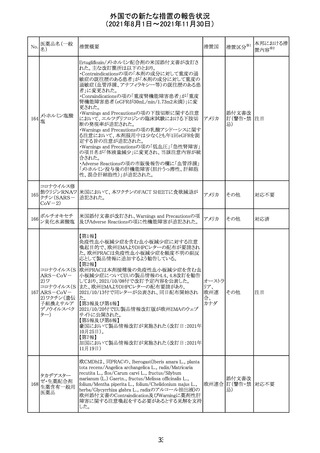
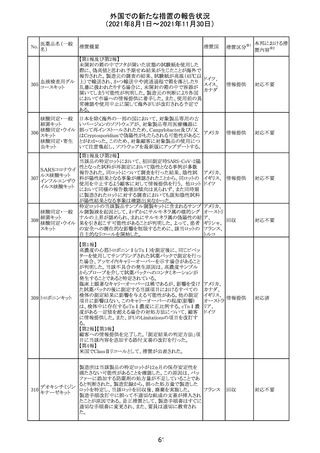
CDS_v8.0が報告され、安全性情報が改訂された。
本改訂は、用法用量に関する記載整備、HAVEN6の臨床
試験データの追加、PRACからのリクエストを受けたことによ
エミシズマブ(遺 る臨床試験、市販後における過敏症反応の発現状況の評
127
スイス
伝子組換え)
価結果に基づく改訂である。
市販後において本剤との因果関係が否定できない血管浮
腫、蕁麻疹、発疹を発現した症例が認められていることか
ら、これらの事象をPost Marketingの項に追記した。
125
25
注目
注目
対応済
その他
注目
情報提供
対応不要
その他
注目
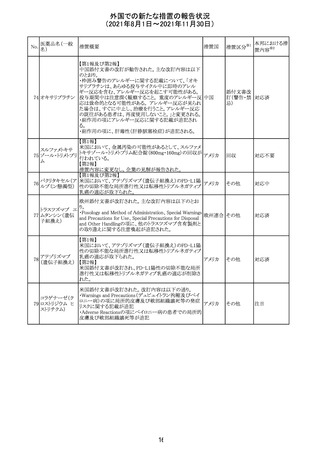
(2021年8月1日~2021年11月30日)
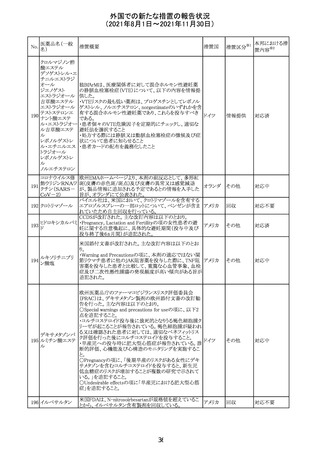
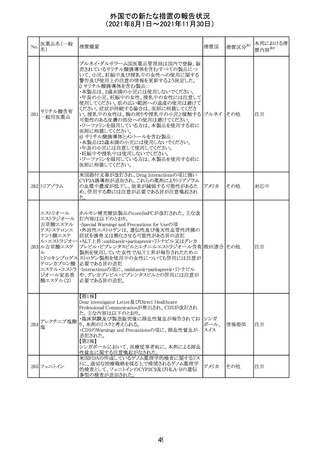
No.
医薬品名(一般
名)
措置概要
措置国
措置区分
※1
本邦における措
※2
置内容
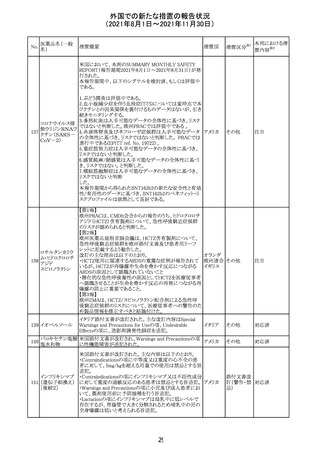
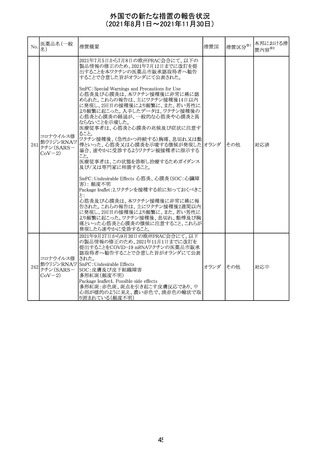
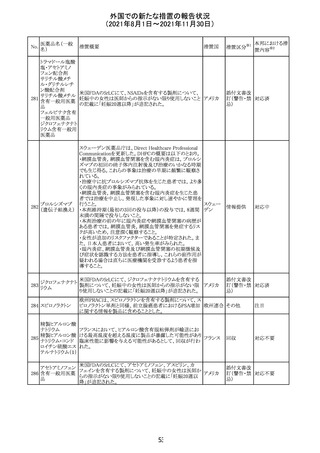
欧州PRACは、2021年8月30日から2021年9月2日に開催さ
れた会議において、製造販売業者からの最新の月間安全
性報告概要(Monthly Summary Safety Report; MSSR)、並
びに患者及び医療従事者からEudraVigilanceに報告され
たデータ(第2項参照)を含む新たな安全性データを評価し
た。
現時点では、製品情報の更新に関する勧告はない。
コロナウイルス修
飾ウリジンRNAワ ・心筋炎及び心膜炎
122
オランダ その他
クチン(SARS- 現時点で、本ワクチンの製品情報のさらなる更新はない。
CoV-2)
心筋炎及び心膜炎は、2021年7月のPRACによる評価後、
本ワクチンの製品情報の副反応及び警告の項に追加され
ている。
123 エンザルタミド
・多臓器炎症症候群(MIS)
コミナティに伴う多臓器炎症症候群(MIS)の報告後、
COVID-19ワクチンによるMISのリスクの有無を評価中であ
る。
マレーシア添付文書が改訂された。主な改訂内容は以下
のとおり。
・Special Warnings and Precautions for Useの項に、第2原 マレーシ
その他
発性悪性疾患が報告されている旨が追記された。
ア
・Special Warnings and Precautions for Useの過敏症反応
の項に、重度皮膚副作用が追記された。
豪TGAは、医療専門家に対し、エレヌマブの製品情報が改
訂されていることを通知した。 改訂内容は以下のとおり。
・Special Warnings and Precautions for Useに「高血圧」の
エレヌマブ(遺伝 項が追加され、国際的に本剤の市販後において高血圧の オーストラ
124
情報提供
子組換え)
発現及び既存の高血圧の悪化が報告されていることが記 リア
載された。
・Adverse Effects[Undesirable Effects]の「血管障害」の項
に、高血圧が追記された。
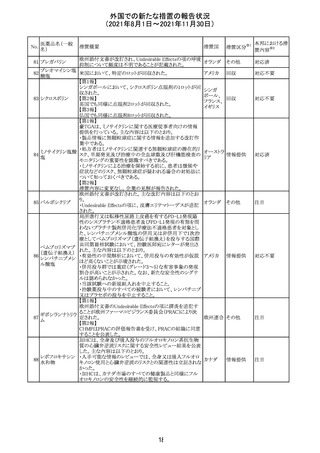
欧州添付文書が改訂され、Special Warnings and
クエチアピンフマ
Precautions for Useの重度の皮膚障害の項に、急性汎発 イギリス
ル酸塩
性発疹性膿疱症、多形紅斑が追記された。
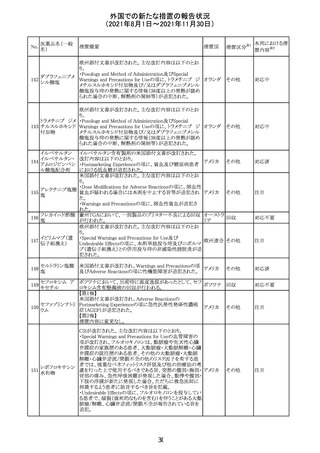
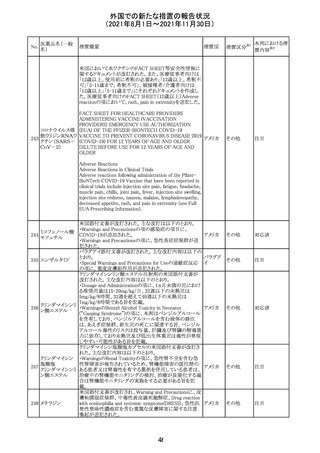
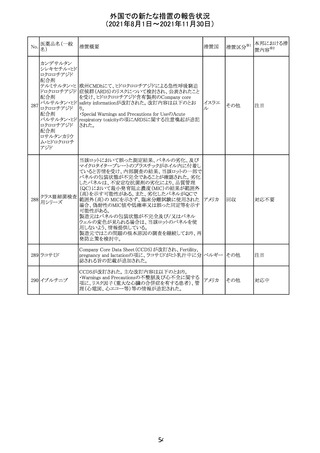
スイスにおいて、glofitamabの治験医師宛に情報が発出さ
れた。主な内容は以下のとおり。
・活動性感染が判明している患者、潜伏感染が再活性化し
ている患者、入院又は最初の治験薬投与前4週間以内に
抗生物質の静注による治療を必要とする感染の主要なエ
オビヌツズマブ
ピソードを有する患者は治療から除外すべきである。
126
スイス
(遺伝子組換え) ・オビヌツズマブ(glofitamab投与前のサイトカイン放出症候
群に対する予防的前処置として使われる)投与中及び投与
終了後に重篤な細菌感染症、真菌感染症、新たなウイルス
感染症又は再活性化ウイルス感染症が発現する可能性が
あることから、オビヌツズマブは活動性感染症患者に投与
しないこと。
CDS_v8.0が報告され、安全性情報が改訂された。
本改訂は、用法用量に関する記載整備、HAVEN6の臨床
試験データの追加、PRACからのリクエストを受けたことによ
エミシズマブ(遺 る臨床試験、市販後における過敏症反応の発現状況の評
127
スイス
伝子組換え)
価結果に基づく改訂である。
市販後において本剤との因果関係が否定できない血管浮
腫、蕁麻疹、発疹を発現した症例が認められていることか
ら、これらの事象をPost Marketingの項に追記した。
125
25
注目
注目
対応済
その他
注目
情報提供
対応不要
その他
注目