よむ、つかう、まなぶ。
資料2-3 外国での新たな措置の報告状況 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24331.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和3年度 第3回 3/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
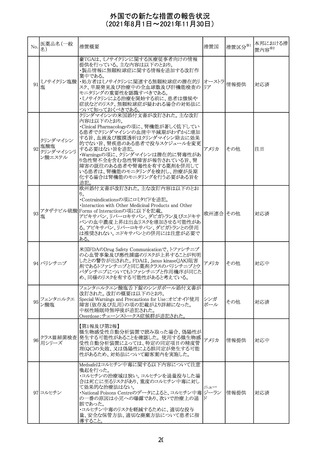
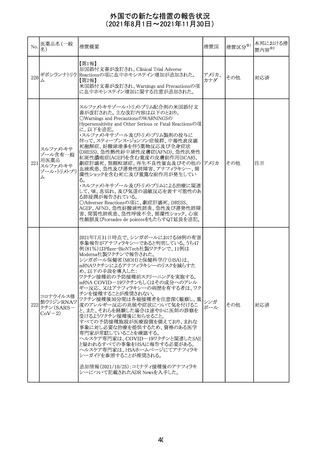
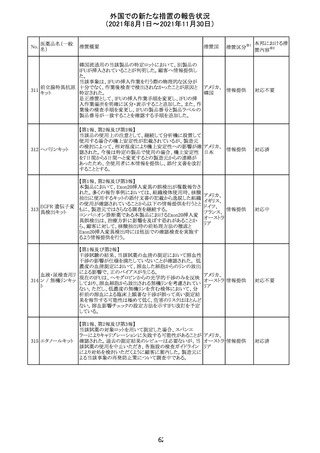
外国での新たな措置の報告状況
(2021年8月1日~2021年11月30日)
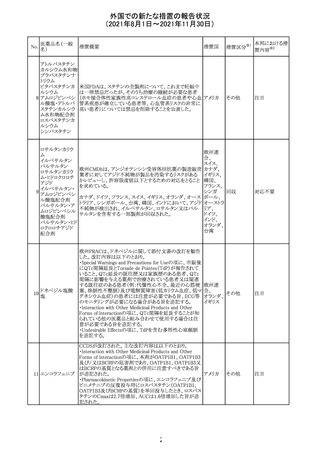
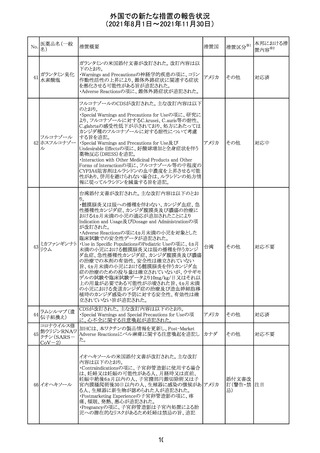
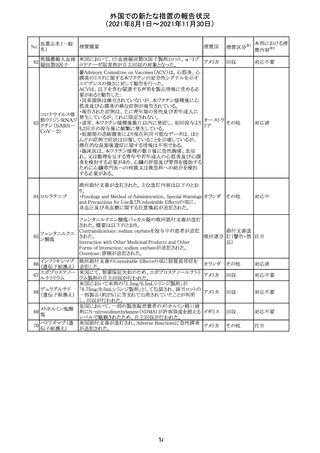
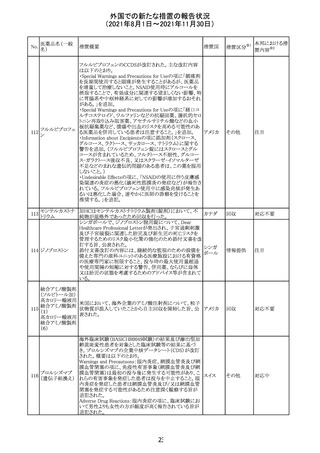
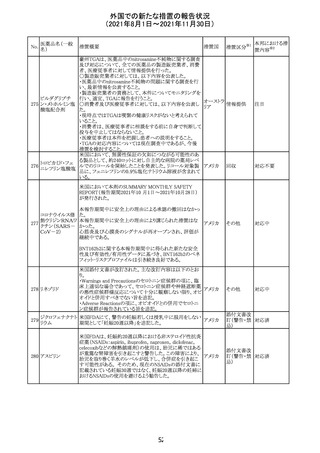
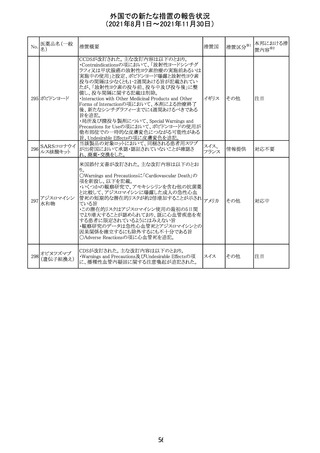
医薬品名(一般
名)
措置概要
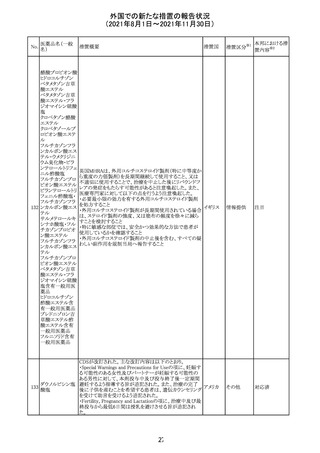
12
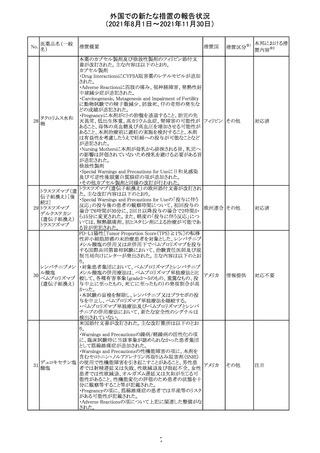
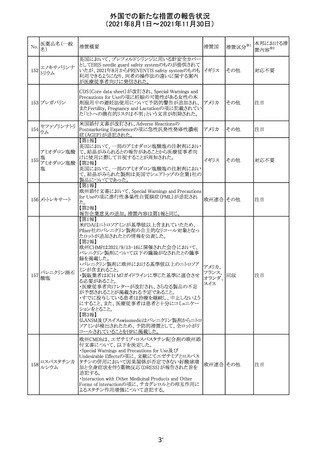
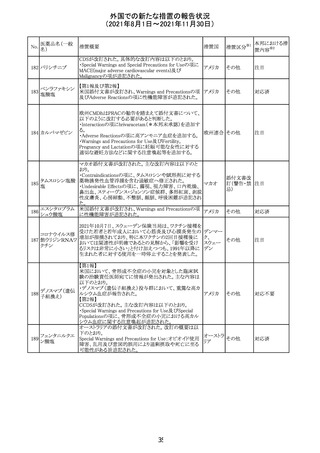
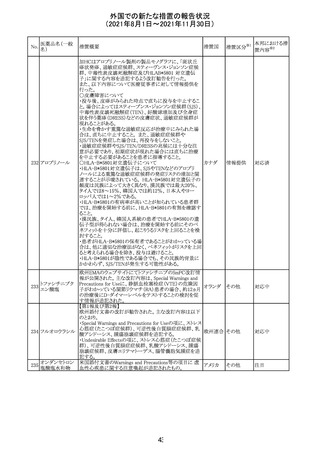
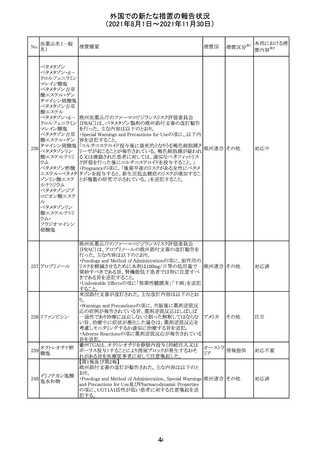
カプマチニブ塩
酸塩水和物
【第1報】
治験責任医師宛に情報が発出された。主な内容は以下の
とおり。
・METエクソン14スキッピング変異を有する局所進行性又
は転移性の非小細胞肺癌の一次治療としてカプマチニブ
及びspartalizumab併用投与とカプマチニブ及びプラセボ
投与の有効性及び安全性を評価する国際共同第Ⅱ相試
験において、カプマチニブ及びspartalizumab併用療法の
忍容性が認められなかったため、患者登録を中止すること
を決定した。
・併用投与により毒性が高まるリスクがあるので、カプマチ
ニブ及びspartalizumabの併用投与を受けている被験者
は、spartalizumabの投与を中止すること。
【第2報】
中国、
治験責任医師宛に情報が発出された。主な内容は以下の スイス
とおり。
・因果関係を問わない主な有害事象は末梢性浮腫 11例
(42.3%、うち3例(11.5%)がグレード3/4)、血中クレアチニ
ン増加 10例(38.5%)、悪心 9例(34.6%)、ALT増加 8例
(30.8%、うち7例(26.9%)がグレード3/4)、AST増加 8例
(30.8%、うち2例(7.7%)がグレード3/4)であった。
・治療との関連が疑われる重篤な有害事象が7例(26.9%)
に発現し、このうち6例(23.1%)にグレード3/4の重篤な有
害事象が発現した。死亡に至った重篤な有害事象は1例発
現し、治験薬との因果関係はないと考えられた。
カプマチニブ及びspartalizumab併用において、想定以上
の休薬/減量及び/又は中止率が認められたため、カプマ
チニブ単剤療法の方が有益であると考えられた。
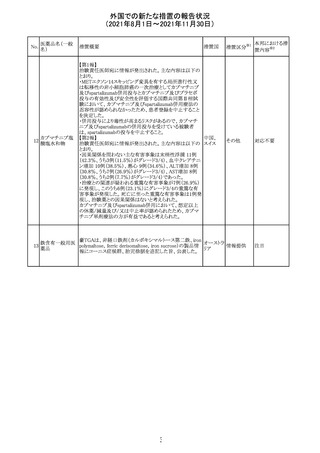
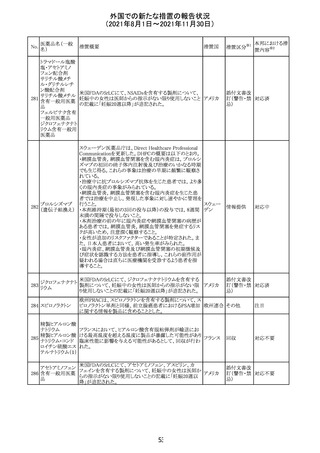
13
豪TGAは、非経口鉄剤(カルボキシマルトース第二鉄、iron
鉄含有一般用医
オーストラ
polymaltose,ferric derisomaltose,iron sucrose)の製品情
情報提供
薬品
リア
報にコーニス症候群、胎児徐脈を追記した旨、公表した。
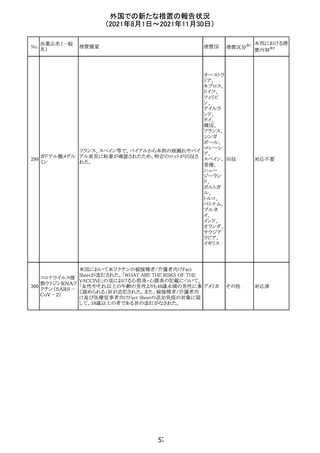
No.
措置国
3
措置区分
その他
※1
本邦における措
※2
置内容
対応不要
注目
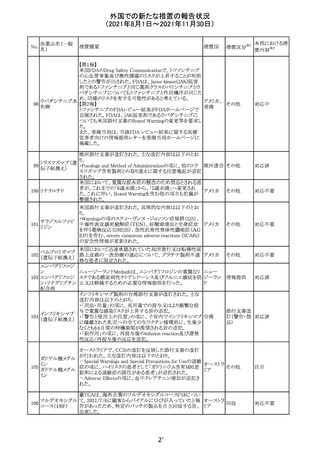
(2021年8月1日~2021年11月30日)
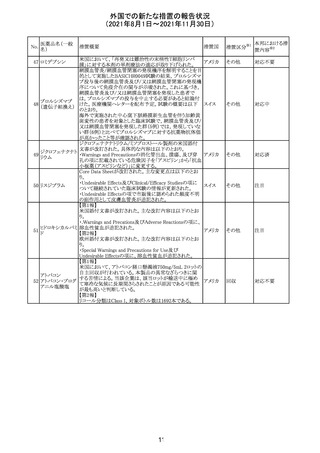
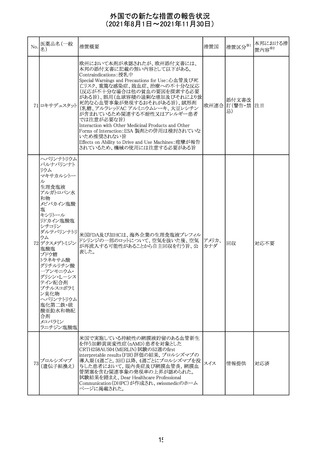
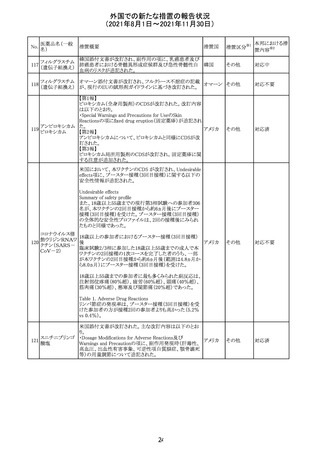
医薬品名(一般
名)
措置概要
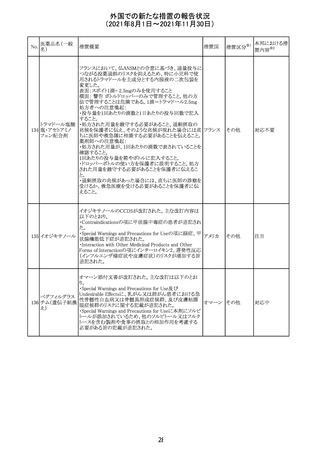
12
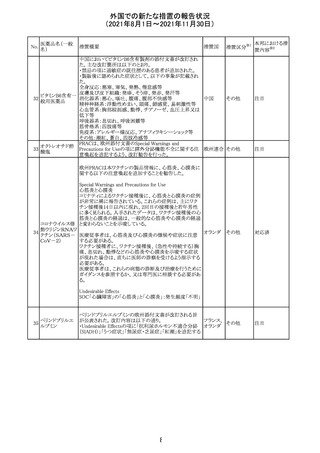
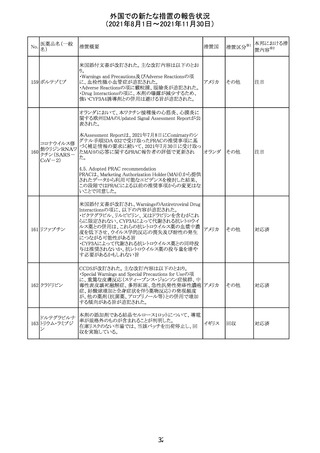
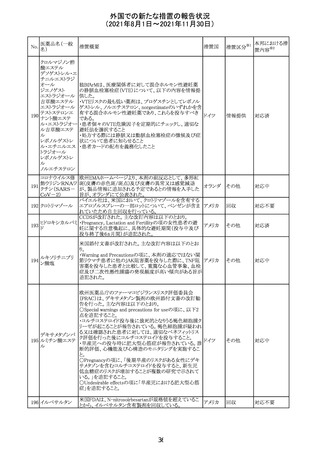
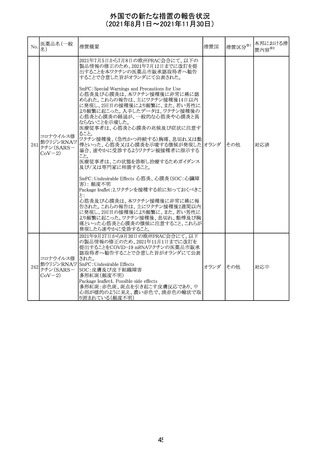
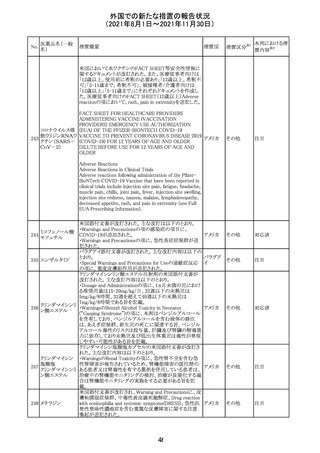
カプマチニブ塩
酸塩水和物
【第1報】
治験責任医師宛に情報が発出された。主な内容は以下の
とおり。
・METエクソン14スキッピング変異を有する局所進行性又
は転移性の非小細胞肺癌の一次治療としてカプマチニブ
及びspartalizumab併用投与とカプマチニブ及びプラセボ
投与の有効性及び安全性を評価する国際共同第Ⅱ相試
験において、カプマチニブ及びspartalizumab併用療法の
忍容性が認められなかったため、患者登録を中止すること
を決定した。
・併用投与により毒性が高まるリスクがあるので、カプマチ
ニブ及びspartalizumabの併用投与を受けている被験者
は、spartalizumabの投与を中止すること。
【第2報】
中国、
治験責任医師宛に情報が発出された。主な内容は以下の スイス
とおり。
・因果関係を問わない主な有害事象は末梢性浮腫 11例
(42.3%、うち3例(11.5%)がグレード3/4)、血中クレアチニ
ン増加 10例(38.5%)、悪心 9例(34.6%)、ALT増加 8例
(30.8%、うち7例(26.9%)がグレード3/4)、AST増加 8例
(30.8%、うち2例(7.7%)がグレード3/4)であった。
・治療との関連が疑われる重篤な有害事象が7例(26.9%)
に発現し、このうち6例(23.1%)にグレード3/4の重篤な有
害事象が発現した。死亡に至った重篤な有害事象は1例発
現し、治験薬との因果関係はないと考えられた。
カプマチニブ及びspartalizumab併用において、想定以上
の休薬/減量及び/又は中止率が認められたため、カプマ
チニブ単剤療法の方が有益であると考えられた。
13
豪TGAは、非経口鉄剤(カルボキシマルトース第二鉄、iron
鉄含有一般用医
オーストラ
polymaltose,ferric derisomaltose,iron sucrose)の製品情
情報提供
薬品
リア
報にコーニス症候群、胎児徐脈を追記した旨、公表した。
No.
措置国
3
措置区分
その他
※1
本邦における措
※2
置内容
対応不要
注目