よむ、つかう、まなぶ。
参考資料3 RevMate Ver.6.2 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_25755.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第4回 5/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1.
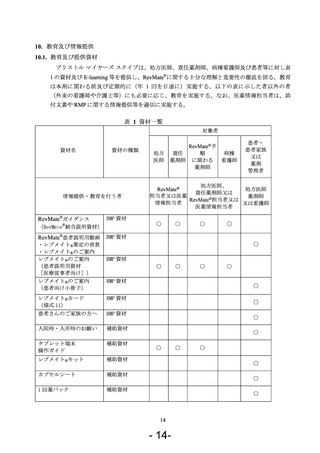
背景(RevMate®;レブラミド®・ポマリスト®適正管理手順策定の経緯)
レブラミド®(一般名:レナリドミド水和物)及びポマリスト®(一般名:ポマリドミド)
は免疫調節薬(IMiDs®)と呼ばれる薬剤の 1 種であり、ヒトで催奇形性を示すサリドマイド
の誘導体である。レナリドミド水和物は妊娠カニクイザルを用いた試験で、出生児に奇形が
認められている。一方、ポマリドミドは妊娠ウサギ、妊娠ラットを用いた試験で出生児に奇
形が認められている。したがって、ブリストル・マイヤーズ スクイブ株式会社(以下、ブリ
ストル マイヤーズ スクイブ)では、これらの薬剤はヒトに対しても催奇形性を示す可能性が
ある薬剤として慎重に取り扱い、胎児への薬剤曝露の防止を目的とした厳格な薬剤配布プロ
グラムの下で患者に提供されるべきであると考えている。
レブラミド®は米国、欧州をはじめ世界各国で販売され、日本では 2010 年 7 月に販売され
ている。一方、ポマリスト®は米国及び欧州において 2013 年に販売された。米国では胎児へ
の薬剤曝露の防止を目的として、「Revlimid REMS®」、「Pomalyst REMS®」と呼ばれる薬剤
配布プログラムを、また、欧州では Summary of Product Characteristics(SmPC)の Pregnancy
Prevention Program(PPP)を基本に、欧州各国の医療環境に応じた薬剤配布プログラムを用い
て両剤が患者に提供されている。
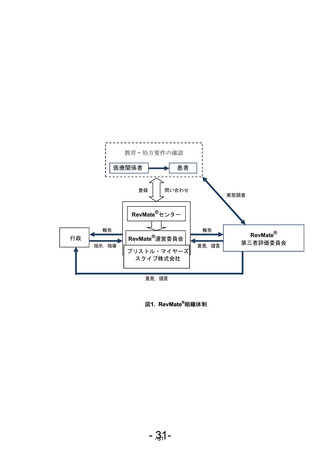
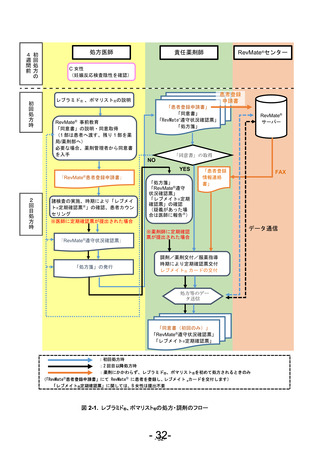
このように胎児への薬剤曝露の防止を十分に達成するためには、これらの薬剤が処方され
る各国の医療環境に応じた薬剤配布プログラムを構築、実施することが重要である。セルジ
ーン株式会社(以下、セルジーン)は、本邦でレブラミド®を販売するにあたり、患者、医師、
薬剤師及び各関係団体と本邦の現状に即した薬剤配布プログラムの構築を図り、2010 年 6 月
にレブラミド®の流通管理を含めた RevMate®(レブラミド®適正管理手順)を策定し、その後
も必要な改訂を行ってきた。また、2015 年 5 月にポマリスト ® が発売されたことを機に、
RevMate®(レブラミド®適正管理手順)を「RevMate®(レブラミド®・ポマリスト®適正管理
手順)」に改訂をした。
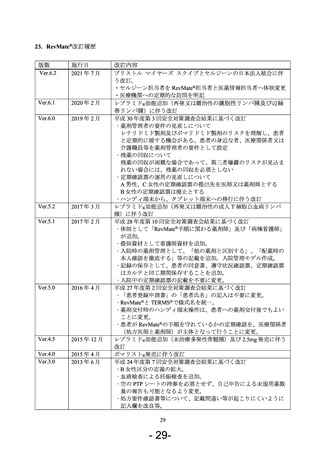
この管理手順に関し、「サリドマイド及びレナリドミドの安全管理に関する検討会報告書」
が平成 26 年(2014 年)12 月に出され、患者と医療関係者の信頼関係に基づく安全管理の導
入、及び患者の治療アクセスへの支障抑止のための管理手順の負担軽減が求められ、2016 年
4 月に改訂を行い、2016 年度に入院病棟で発生したレブラミド®誤投与を受け、2017 年 2 月に
入院時の薬剤の管理方法の記載と病棟看護師等への情報提供を追加する改訂をした。
2019 年 2 月、TERMS®第三者評価委員会の指摘事項と RevMate®第三者評価委員会の提言書
を受けて、2018 年 4 月に開催された第 8 回サリドマイド及びレナリドミドの安全管理に関す
る検討会及び 2018 年 6 月に開催された平成 30 年度第 3 回薬事・食品衛生審議会薬事分科会医
薬品等安全対策部会安全対策調査会での審議結果に基づき、薬剤管理者の要件の見直し、残
薬の回収、定期確認票の運用の見直しについて改訂をした。また、ハンディ端末から、タブ
レット端末への移行に伴う改訂をした。
2021 年 7 月、ブリストル マイヤーズ スクイブとセルジーンの日本法人統合が完了したこと
に伴う改訂をした。また、セルジーン担当者を RevMate®担当者と医薬情報担当者へ体制変更
し、安全管理手順の実施状況の確認は RevMate®担当者がプロモーション活動とは独立した形
で実施する改訂をした。
4
- 4-
背景(RevMate®;レブラミド®・ポマリスト®適正管理手順策定の経緯)
レブラミド®(一般名:レナリドミド水和物)及びポマリスト®(一般名:ポマリドミド)
は免疫調節薬(IMiDs®)と呼ばれる薬剤の 1 種であり、ヒトで催奇形性を示すサリドマイド
の誘導体である。レナリドミド水和物は妊娠カニクイザルを用いた試験で、出生児に奇形が
認められている。一方、ポマリドミドは妊娠ウサギ、妊娠ラットを用いた試験で出生児に奇
形が認められている。したがって、ブリストル・マイヤーズ スクイブ株式会社(以下、ブリ
ストル マイヤーズ スクイブ)では、これらの薬剤はヒトに対しても催奇形性を示す可能性が
ある薬剤として慎重に取り扱い、胎児への薬剤曝露の防止を目的とした厳格な薬剤配布プロ
グラムの下で患者に提供されるべきであると考えている。
レブラミド®は米国、欧州をはじめ世界各国で販売され、日本では 2010 年 7 月に販売され
ている。一方、ポマリスト®は米国及び欧州において 2013 年に販売された。米国では胎児へ
の薬剤曝露の防止を目的として、「Revlimid REMS®」、「Pomalyst REMS®」と呼ばれる薬剤
配布プログラムを、また、欧州では Summary of Product Characteristics(SmPC)の Pregnancy
Prevention Program(PPP)を基本に、欧州各国の医療環境に応じた薬剤配布プログラムを用い
て両剤が患者に提供されている。
このように胎児への薬剤曝露の防止を十分に達成するためには、これらの薬剤が処方され
る各国の医療環境に応じた薬剤配布プログラムを構築、実施することが重要である。セルジ
ーン株式会社(以下、セルジーン)は、本邦でレブラミド®を販売するにあたり、患者、医師、
薬剤師及び各関係団体と本邦の現状に即した薬剤配布プログラムの構築を図り、2010 年 6 月
にレブラミド®の流通管理を含めた RevMate®(レブラミド®適正管理手順)を策定し、その後
も必要な改訂を行ってきた。また、2015 年 5 月にポマリスト ® が発売されたことを機に、
RevMate®(レブラミド®適正管理手順)を「RevMate®(レブラミド®・ポマリスト®適正管理
手順)」に改訂をした。
この管理手順に関し、「サリドマイド及びレナリドミドの安全管理に関する検討会報告書」
が平成 26 年(2014 年)12 月に出され、患者と医療関係者の信頼関係に基づく安全管理の導
入、及び患者の治療アクセスへの支障抑止のための管理手順の負担軽減が求められ、2016 年
4 月に改訂を行い、2016 年度に入院病棟で発生したレブラミド®誤投与を受け、2017 年 2 月に
入院時の薬剤の管理方法の記載と病棟看護師等への情報提供を追加する改訂をした。
2019 年 2 月、TERMS®第三者評価委員会の指摘事項と RevMate®第三者評価委員会の提言書
を受けて、2018 年 4 月に開催された第 8 回サリドマイド及びレナリドミドの安全管理に関す
る検討会及び 2018 年 6 月に開催された平成 30 年度第 3 回薬事・食品衛生審議会薬事分科会医
薬品等安全対策部会安全対策調査会での審議結果に基づき、薬剤管理者の要件の見直し、残
薬の回収、定期確認票の運用の見直しについて改訂をした。また、ハンディ端末から、タブ
レット端末への移行に伴う改訂をした。
2021 年 7 月、ブリストル マイヤーズ スクイブとセルジーンの日本法人統合が完了したこと
に伴う改訂をした。また、セルジーン担当者を RevMate®担当者と医薬情報担当者へ体制変更
し、安全管理手順の実施状況の確認は RevMate®担当者がプロモーション活動とは独立した形
で実施する改訂をした。
4
- 4-