よむ、つかう、まなぶ。
薬-1薬価基準見直し案 (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_68745.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第246回 1/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2~4 (略)
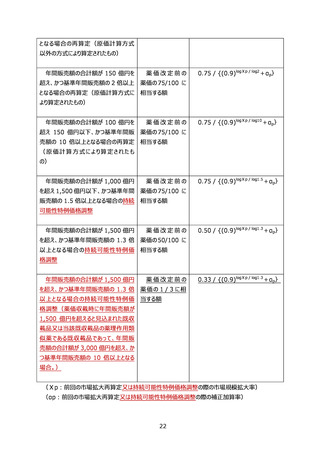
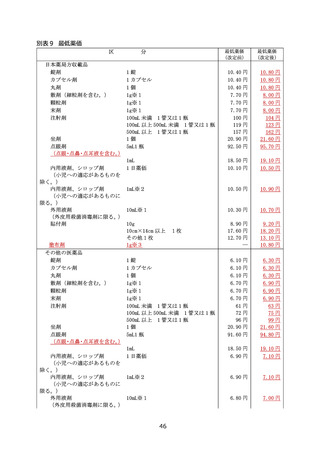
別表 10 新規作用機序医薬品の革新性及び有用性に係る基準
1 新規作用機序により既存治療で効果不十分な疾患に有効性を示したものであること
当該疾患に対する標準療法で効果不十分又は不耐容の患者を含む臨床試験(当初の承認を目
的として実施されたもので、効果不十分又は不耐容の患者の目標症例数が事前に設定された企業治
験に限る。)において有効性が示されることなどにより、添付文書の効能・効果、使用上の注意、臨床成
績の項において、これらの患者に対して投与可能であることが明示的になっているものであること。
2 新規作用機序により既存治療に対して比較試験により優越性を示したものであること
対象疾患に対する既存治療(本邦における治療方法として妥当性があるものに限る。)を対照群
(プラセボ除く)に設定した臨床試験(当初の承認を目的として実施されたもので、優越性を検証する
ことを目的とした仮説に基づき実施された企業治験に限る。)を実施し、主要評価項目において既存治
療に対する本剤の優越性が示されていること。また、製造販売後において、当初の承認時の疾患を対象
とした製造販売後臨床試験も同様に取り扱うものとする。
注)既存治療を対照群とし、既存治療に本剤を上乗せした比較試験によって優越性が検証された場
合は除く。
用法・用量を変更した群を対照とした場合や、同一有効成分の医薬品を対照としたものは除く。
製剤改良など、活性本体に明確な変更がない新薬は除く。
製造販売後臨床試験の場合においても、既存治療は本邦における治療方法として妥当性があ
るものに限り、優越性を検証することを目的とした仮説に基づき実施された試験に限る。
3 新規作用機序により認められた効能を有する他の医薬品が存在しないこと
薬事承認時点において、本剤と効能・効果が一致するものがなく、対象疾患に対して初めての治療選
択肢を提供するもの、又は類似の効能・効果を有する既存薬と比べて、治療対象となる患者の範囲が
拡大することが明らかであるもの。
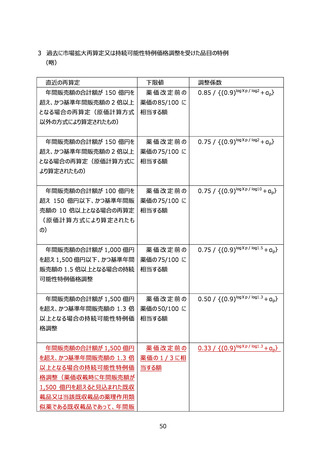
別表 10 革新的新薬薬価維持制度の対象企業の確認事項
確認事項(過去5年間の実績)
A-1
国内試験(日本を含む国際共同試験を含む)(実施数)
(PhaseⅡ以降)
A-2
新薬収載実績(収載成分数)
A-3
革新性のある新薬の収載実績(収載成分数)
A-4
薬剤耐性菌の治療薬の収載実績(収載成分数)
A-5
新型コロナウイルスの治療等に用いる医薬品の開発実績(承認取得数)
16
別表 10 新規作用機序医薬品の革新性及び有用性に係る基準
1 新規作用機序により既存治療で効果不十分な疾患に有効性を示したものであること
当該疾患に対する標準療法で効果不十分又は不耐容の患者を含む臨床試験(当初の承認を目
的として実施されたもので、効果不十分又は不耐容の患者の目標症例数が事前に設定された企業治
験に限る。)において有効性が示されることなどにより、添付文書の効能・効果、使用上の注意、臨床成
績の項において、これらの患者に対して投与可能であることが明示的になっているものであること。
2 新規作用機序により既存治療に対して比較試験により優越性を示したものであること
対象疾患に対する既存治療(本邦における治療方法として妥当性があるものに限る。)を対照群
(プラセボ除く)に設定した臨床試験(当初の承認を目的として実施されたもので、優越性を検証する
ことを目的とした仮説に基づき実施された企業治験に限る。)を実施し、主要評価項目において既存治
療に対する本剤の優越性が示されていること。また、製造販売後において、当初の承認時の疾患を対象
とした製造販売後臨床試験も同様に取り扱うものとする。
注)既存治療を対照群とし、既存治療に本剤を上乗せした比較試験によって優越性が検証された場
合は除く。
用法・用量を変更した群を対照とした場合や、同一有効成分の医薬品を対照としたものは除く。
製剤改良など、活性本体に明確な変更がない新薬は除く。
製造販売後臨床試験の場合においても、既存治療は本邦における治療方法として妥当性があ
るものに限り、優越性を検証することを目的とした仮説に基づき実施された試験に限る。
3 新規作用機序により認められた効能を有する他の医薬品が存在しないこと
薬事承認時点において、本剤と効能・効果が一致するものがなく、対象疾患に対して初めての治療選
択肢を提供するもの、又は類似の効能・効果を有する既存薬と比べて、治療対象となる患者の範囲が
拡大することが明らかであるもの。
別表 10 革新的新薬薬価維持制度の対象企業の確認事項
確認事項(過去5年間の実績)
A-1
国内試験(日本を含む国際共同試験を含む)(実施数)
(PhaseⅡ以降)
A-2
新薬収載実績(収載成分数)
A-3
革新性のある新薬の収載実績(収載成分数)
A-4
薬剤耐性菌の治療薬の収載実績(収載成分数)
A-5
新型コロナウイルスの治療等に用いる医薬品の開発実績(承認取得数)
16