よむ、つかう、まなぶ。
【資料1】医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律の施行に向けた論点等について.pdf (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59820.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和7年度第2回 7/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
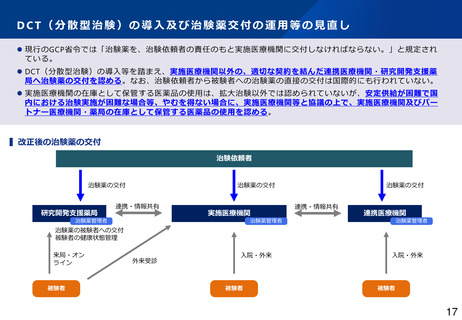
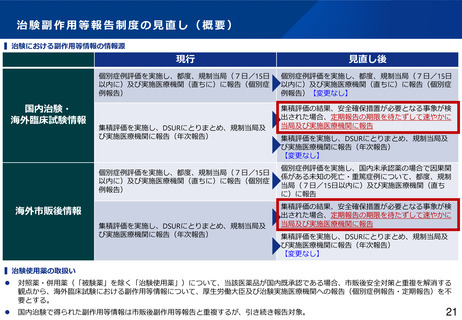
治験副作用等報告制度の見直し(概要)
▍治験における副作用等情報の情報源
国内治験・
海外臨床試験情報
現行
見直し後
個別症例評価を実施し、都度、規制当局(7日/15日
以内に)及び実施医療機関(直ちに)に報告(個別症
例報告)
個別症例評価を実施し、都度、規制当局(7日/15日
以内に)及び実施医療機関(直ちに)に報告(個別症
例報告)【変更なし】
集積評価を実施し、DSURにとりまとめ、規制当局及
び実施医療機関に報告(年次報告)
個別症例評価を実施し、都度、規制当局(7日/15日
以内に)及び実施医療機関(直ちに)に報告(個別症
例報告)
海外市販後情報
集積評価を実施し、DSURにとりまとめ、規制当局及
び実施医療機関に報告(年次報告)
集積評価の結果、安全確保措置が必要となる事象が検
出された場合、定期報告の期限を待たずして速やかに
当局及び実施医療機関に報告
集積評価を実施し、DSURにとりまとめ、規制当局及
び実施医療機関に報告(年次報告)
【変更なし】
個別症例評価を実施し、国内未承認薬の場合で因果関
係がある未知の死亡・重篤症例について、都度、規制
当局(7日/15日以内に)及び実施医療機関(直ち
に)に報告
集積評価の結果、安全確保措置が必要となる事象が検
出された場合、定期報告の期限を待たずして速やかに
当局及び実施医療機関に報告
集積評価を実施し、DSURにとりまとめ、規制当局及
び実施医療機関に報告(年次報告)
【変更なし】
▍治験使用薬の取扱い
⚫
対照薬・併用薬(「被験薬」を除く「治験使用薬」)について、当該医薬品が国内既承認である場合、市販後安全対策と重複を解消する
観点から、海外臨床試験における副作用等情報について、厚生労働大臣及び治験実施医療機関への報告(個別症例報告・定期報告)を不
要とする。
⚫
国内治験で得られた副作用等情報は市販後副作用等報告と重複するが、引き続き報告対象。
21
▍治験における副作用等情報の情報源
国内治験・
海外臨床試験情報
現行
見直し後
個別症例評価を実施し、都度、規制当局(7日/15日
以内に)及び実施医療機関(直ちに)に報告(個別症
例報告)
個別症例評価を実施し、都度、規制当局(7日/15日
以内に)及び実施医療機関(直ちに)に報告(個別症
例報告)【変更なし】
集積評価を実施し、DSURにとりまとめ、規制当局及
び実施医療機関に報告(年次報告)
個別症例評価を実施し、都度、規制当局(7日/15日
以内に)及び実施医療機関(直ちに)に報告(個別症
例報告)
海外市販後情報
集積評価を実施し、DSURにとりまとめ、規制当局及
び実施医療機関に報告(年次報告)
集積評価の結果、安全確保措置が必要となる事象が検
出された場合、定期報告の期限を待たずして速やかに
当局及び実施医療機関に報告
集積評価を実施し、DSURにとりまとめ、規制当局及
び実施医療機関に報告(年次報告)
【変更なし】
個別症例評価を実施し、国内未承認薬の場合で因果関
係がある未知の死亡・重篤症例について、都度、規制
当局(7日/15日以内に)及び実施医療機関(直ち
に)に報告
集積評価の結果、安全確保措置が必要となる事象が検
出された場合、定期報告の期限を待たずして速やかに
当局及び実施医療機関に報告
集積評価を実施し、DSURにとりまとめ、規制当局及
び実施医療機関に報告(年次報告)
【変更なし】
▍治験使用薬の取扱い
⚫
対照薬・併用薬(「被験薬」を除く「治験使用薬」)について、当該医薬品が国内既承認である場合、市販後安全対策と重複を解消する
観点から、海外臨床試験における副作用等情報について、厚生労働大臣及び治験実施医療機関への報告(個別症例報告・定期報告)を不
要とする。
⚫
国内治験で得られた副作用等情報は市販後副作用等報告と重複するが、引き続き報告対象。
21