よむ、つかう、まなぶ。
【資料1】医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律の施行に向けた論点等について.pdf (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59820.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和7年度第2回 7/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
医薬品の臨床試験の実施の基準に関する省令(GCP省令)等の見直し(2)
検討の方向性(案)
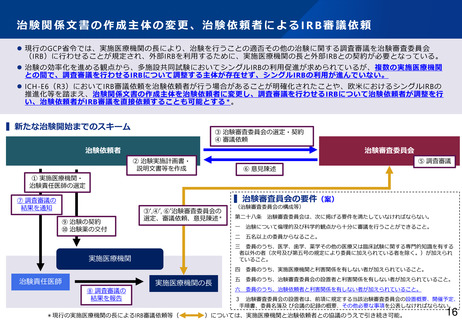
【シングルIRBの原則化】
• 現在、治験実施医療機関ごとに設けられている治験審査委員会(IRB)について、治験依頼者が直接IRBに審議
を依頼できるようにし、多施設共同試験におけるシングルIRBの原則化を推進することとしてはどうか。
【DCTの円滑な実施に向けた規制の合理化】
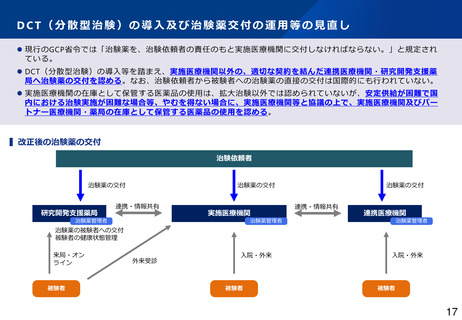
• 患者負担の軽減に資するDCT(分散型治験)の円滑な実施に向けた治験薬交付の運用等の見直し、GCP適合性
調査等の合理化(リスクに応じて実施範囲を変更する等)を促進してはどうか。
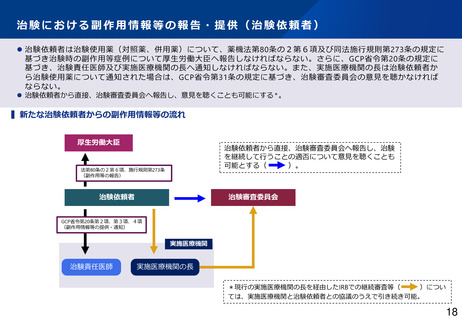
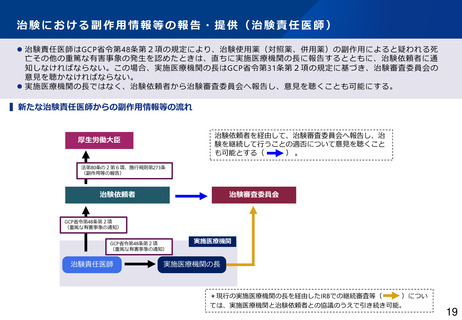
【リスクに応じた治験副作用等の情報収集・評価】
• 被験薬以外の医薬品(対照薬、併用薬)が、日本で既承認である場合には、市販後安全対策の枠組みで把握す
ることとしてはどうか。
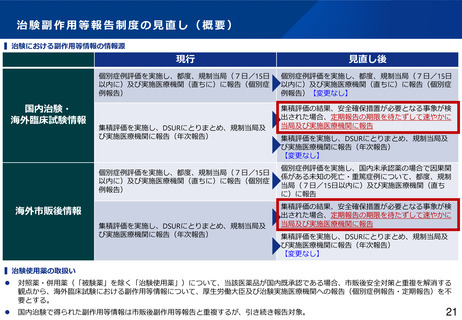
• 被験薬の海外市販後情報に関する個別症例報告について、厚生労働省及び実施医療機関等への網羅的な報告を
日本独自に要求しているが、海外臨床試験により副作用情報が適切に収集されていることを踏まえ、膨大な件
数の個別症例報告を実施医療機関・IRB等に届けるのではなく、重要度の高い副作用情報を選別して適切に届け
る体系に見直してはどうか。さらに、集積評価により安全確保措置が必要となる事象が検出された場合、従来
の定期報告の期限を待たずして速やかに厚生労働省及び実施医療機関等へ報告するよう関係規定を見直しては
どうか。
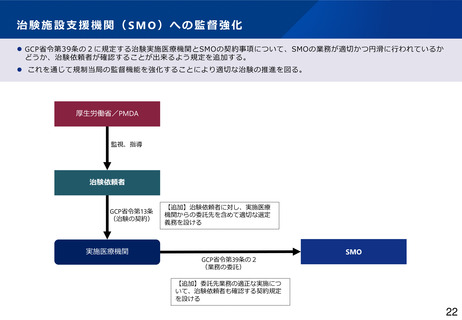
【SMOへの監督強化】
• より適切な治験実施に向けて治験依頼者によるSMOへの監督強化を図るため、治験実施医療機関とSMOの契約
事項(GCP省令第39条の2)に、SMOの業務が適切かつ円滑に行われているかどうかを治験依頼者が確認する
ことが出来る規定を追加することとしてはどうか。
【その他】
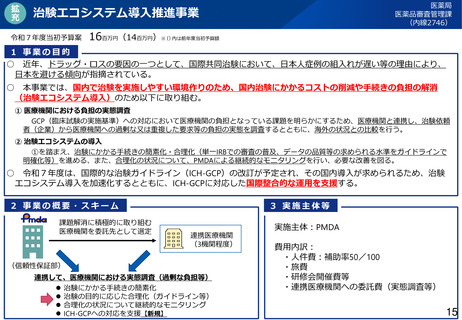
• 引き続き、ICH-E6(R3)の改正内容の反映、治験エコシステム導入推進事業等の推進により、国際的に整合した
治験の運用が浸透するよう、必要な検討を進めてはどうか。
13
検討の方向性(案)
【シングルIRBの原則化】
• 現在、治験実施医療機関ごとに設けられている治験審査委員会(IRB)について、治験依頼者が直接IRBに審議
を依頼できるようにし、多施設共同試験におけるシングルIRBの原則化を推進することとしてはどうか。
【DCTの円滑な実施に向けた規制の合理化】
• 患者負担の軽減に資するDCT(分散型治験)の円滑な実施に向けた治験薬交付の運用等の見直し、GCP適合性
調査等の合理化(リスクに応じて実施範囲を変更する等)を促進してはどうか。
【リスクに応じた治験副作用等の情報収集・評価】
• 被験薬以外の医薬品(対照薬、併用薬)が、日本で既承認である場合には、市販後安全対策の枠組みで把握す
ることとしてはどうか。
• 被験薬の海外市販後情報に関する個別症例報告について、厚生労働省及び実施医療機関等への網羅的な報告を
日本独自に要求しているが、海外臨床試験により副作用情報が適切に収集されていることを踏まえ、膨大な件
数の個別症例報告を実施医療機関・IRB等に届けるのではなく、重要度の高い副作用情報を選別して適切に届け
る体系に見直してはどうか。さらに、集積評価により安全確保措置が必要となる事象が検出された場合、従来
の定期報告の期限を待たずして速やかに厚生労働省及び実施医療機関等へ報告するよう関係規定を見直しては
どうか。
【SMOへの監督強化】
• より適切な治験実施に向けて治験依頼者によるSMOへの監督強化を図るため、治験実施医療機関とSMOの契約
事項(GCP省令第39条の2)に、SMOの業務が適切かつ円滑に行われているかどうかを治験依頼者が確認する
ことが出来る規定を追加することとしてはどうか。
【その他】
• 引き続き、ICH-E6(R3)の改正内容の反映、治験エコシステム導入推進事業等の推進により、国際的に整合した
治験の運用が浸透するよう、必要な検討を進めてはどうか。
13