よむ、つかう、まなぶ。
【資料1】医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律の施行に向けた論点等について.pdf (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59820.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和7年度第2回 7/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
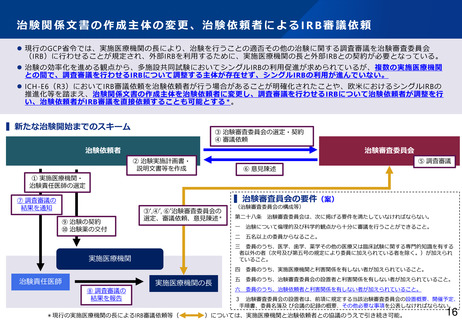
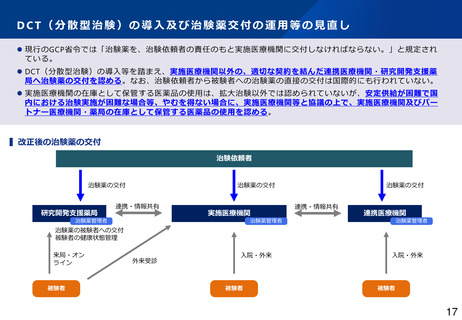
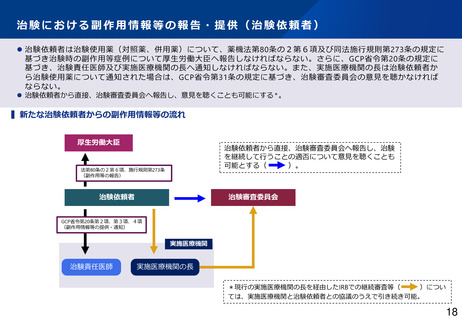
治験における副作用情報等の報告・提供(治験依頼者)
⚫ 治験依頼者は治験使用薬(対照薬、併用薬)について、薬機法第80条の2第6項及び同法施行規則第273条の規定に
基づき治験時の副作用等症例について厚生労働大臣へ報告しなければならない。さらに、GCP省令第20条の規定に
基づき、治験責任医師及び実施医療機関の長へ通知しなければならない。また、実施医療機関の長は治験依頼者か
ら治験使用薬について通知された場合は、GCP省令第31条の規定に基づき、治験審査委員会の意見を聴かなければ
ならない。
⚫ 治験依頼者から直接、治験審査委員会へ報告し、意見を聴くことも可能にする*。
▍新たな治験依頼者からの副作用情報等の流れ
厚生労働大臣
治験依頼者から直接、治験審査委員会へ報告し、治験
を継続して行うことの適否について意見を聴くことも
可能とする(
)。
法第80条の2第6項、施行規則第273条
(副作用等の報告)
治験依頼者
治験審査委員会
GCP省令第20条第2項、第3項、4項
(副作用情報等の提供・通知)
実施医療機関
治験責任医師
実施医療機関の長
*現行の実施医療機関の長を経由したIRBでの継続審査等(
)につい
ては、実施医療機関と治験依頼者との協議のうえで引き続き可能。
18
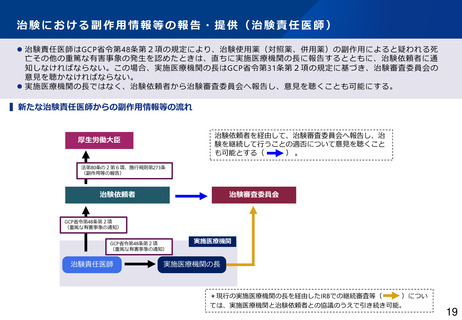
⚫ 治験依頼者は治験使用薬(対照薬、併用薬)について、薬機法第80条の2第6項及び同法施行規則第273条の規定に
基づき治験時の副作用等症例について厚生労働大臣へ報告しなければならない。さらに、GCP省令第20条の規定に
基づき、治験責任医師及び実施医療機関の長へ通知しなければならない。また、実施医療機関の長は治験依頼者か
ら治験使用薬について通知された場合は、GCP省令第31条の規定に基づき、治験審査委員会の意見を聴かなければ
ならない。
⚫ 治験依頼者から直接、治験審査委員会へ報告し、意見を聴くことも可能にする*。
▍新たな治験依頼者からの副作用情報等の流れ
厚生労働大臣
治験依頼者から直接、治験審査委員会へ報告し、治験
を継続して行うことの適否について意見を聴くことも
可能とする(
)。
法第80条の2第6項、施行規則第273条
(副作用等の報告)
治験依頼者
治験審査委員会
GCP省令第20条第2項、第3項、4項
(副作用情報等の提供・通知)
実施医療機関
治験責任医師
実施医療機関の長
*現行の実施医療機関の長を経由したIRBでの継続審査等(
)につい
ては、実施医療機関と治験依頼者との協議のうえで引き続き可能。
18