よむ、つかう、まなぶ。
【資料1】医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律の施行に向けた論点等について.pdf (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59820.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和7年度第2回 7/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
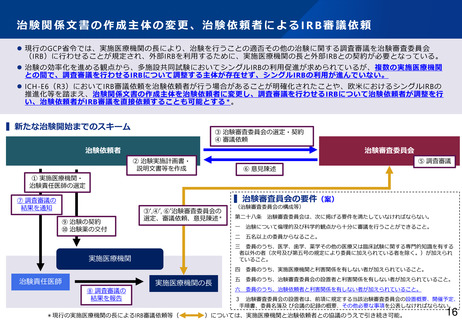
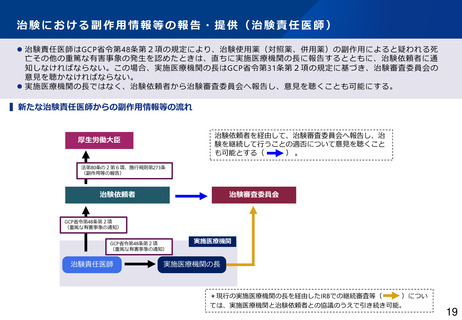
治験における副作用情報等の報告・提供(治験責任医師)
⚫ 治験責任医師はGCP省令第48条第2項の規定により、治験使用薬(対照薬、併用薬)の副作用によると疑われる死
亡その他の重篤な有害事象の発生を認めたときは、直ちに実施医療機関の長に報告するとともに、治験依頼者に通
知しなければならない。この場合、実施医療機関の長はGCP省令第31条第2項の規定に基づき、治験審査委員会の
意見を聴かなければならない。
⚫ 実施医療機関の長ではなく、治験依頼者から治験審査委員会へ報告し、意見を聴くことも可能にする。
▍新たな治験責任医師からの副作用情報等の流れ
治験依頼者を経由して、治験審査委員会へ報告し、治
験を継続して行うことの適否について意見を聴くこと
も可能とする(
)。
厚生労働大臣
法第80条の2第6項、施行規則第273条
(副作用等の報告)
治験依頼者
治験審査委員会
GCP省令第48条第2項
(重篤な有害事象の通知)
GCP省令第48条第2項
(重篤な有害事象の通知)
治験責任医師
実施医療機関
実施医療機関の長
*現行の実施医療機関の長を経由したIRBでの継続審査等(
)につい
ては、実施医療機関と治験依頼者との協議のうえで引き続き可能。
19
⚫ 治験責任医師はGCP省令第48条第2項の規定により、治験使用薬(対照薬、併用薬)の副作用によると疑われる死
亡その他の重篤な有害事象の発生を認めたときは、直ちに実施医療機関の長に報告するとともに、治験依頼者に通
知しなければならない。この場合、実施医療機関の長はGCP省令第31条第2項の規定に基づき、治験審査委員会の
意見を聴かなければならない。
⚫ 実施医療機関の長ではなく、治験依頼者から治験審査委員会へ報告し、意見を聴くことも可能にする。
▍新たな治験責任医師からの副作用情報等の流れ
治験依頼者を経由して、治験審査委員会へ報告し、治
験を継続して行うことの適否について意見を聴くこと
も可能とする(
)。
厚生労働大臣
法第80条の2第6項、施行規則第273条
(副作用等の報告)
治験依頼者
治験審査委員会
GCP省令第48条第2項
(重篤な有害事象の通知)
GCP省令第48条第2項
(重篤な有害事象の通知)
治験責任医師
実施医療機関
実施医療機関の長
*現行の実施医療機関の長を経由したIRBでの継続審査等(
)につい
ては、実施医療機関と治験依頼者との協議のうえで引き続き可能。
19