よむ、つかう、まなぶ。
【資料1】医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律の施行に向けた論点等について.pdf (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59820.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和7年度第2回 7/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
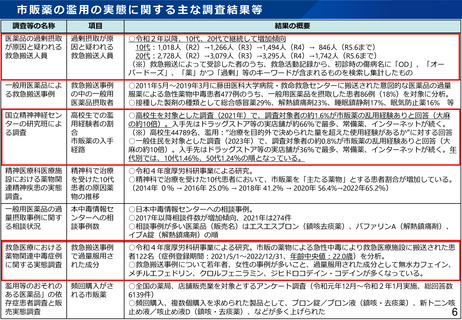
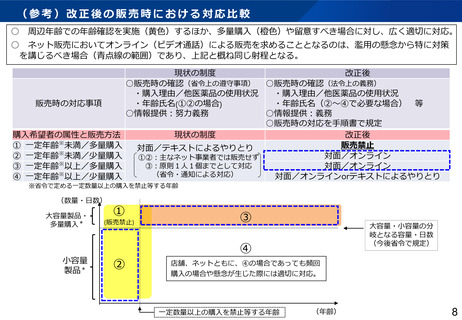
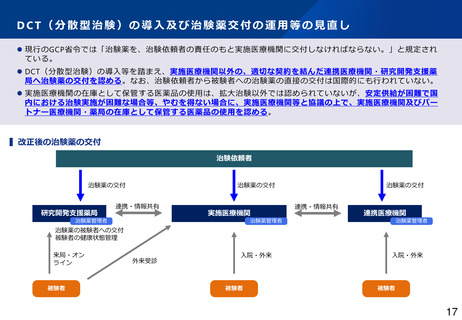
医薬品の臨床試験の実施の基準に関する省令(GCP省令)等の見直し(1)
GCP改正の背景
• 被験者の人権の保護、安全の保持及び福祉の向上を図り、治験の科学的な質及び成績の信頼性を確
保するため、医薬品の臨床試験の実施に係る基準(GCP省令)を定めている。
• GCP省令は国際的な基準であるICH-GCP を法制化したものであるが、近年ICH-GCPについて、臨
床試験環境の急速な進歩がガイドラインに反映されていないことや、Proportionalityが欠如し、臨
床試験への「画一的(one-size-fits-all)」なアプローチになっていること等が指摘されてきた。
• これを受けて、ICH-GCPが2025年1月に改定について合意され、試験の質に関する重要な要因に
焦点を当て、想定されるリスクや目的に適合したアプローチを促進することされたため、日本にお
いても速やかに実装していく必要がある。
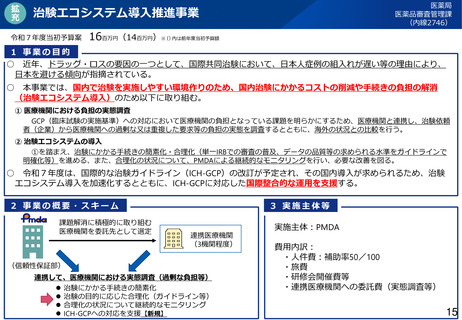
• また、ドラッグ・ロスの要因の一つとして、国際共同治験において、日本人症例の組入れが遅い等
の理由により、日本を避ける傾向が指摘されている。令和6年度より治験エコシステム導入推進事
業を実施し、国内で治験を実施しやすい環境作りのため、国内治験にかかるコストの削減や手続き
の負担の解消のため、医療機関における負担の実態調査や関係業界を交えた検討を進めてきた。
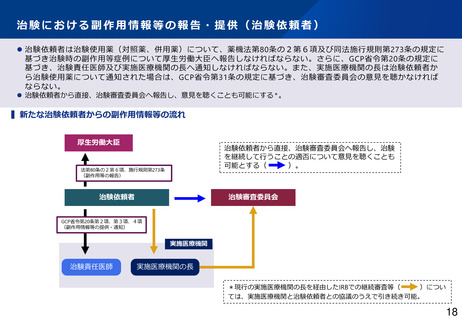
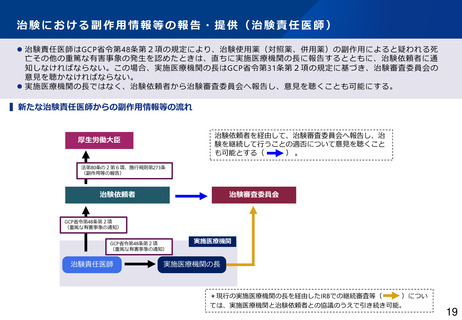
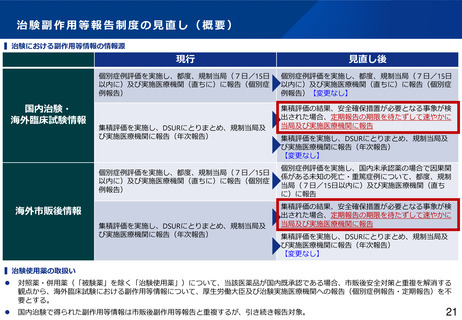
制度部会とりまとめの記載
•
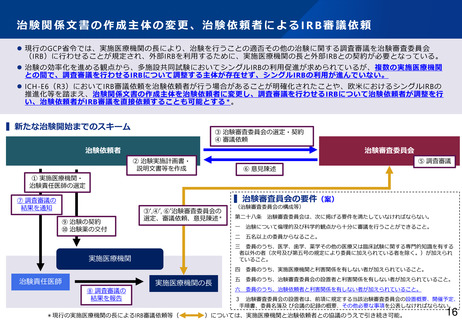
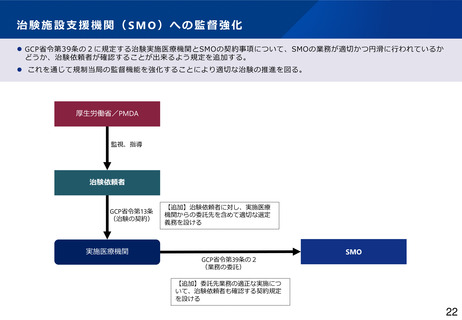
GCP適合性調査について、リスクに応じた調査実施の合理化や、治験施設支援機関(SMO)に対す
る治験依頼者の監督強化を図るほか、GCP Renovation の一環である医薬品規制調和国際会議
(ICH)による「ICH-E6(R3)医薬品の臨床試験の実施に関する基準のガイドライン」の実装も見
据えて、臨床試験の質に関する重要な要因に対するリスクに応じた管理の実施といった新しい考え
方を積極的に導入するなど、治験に携わる従事者の負担軽減を含め治験の更なる効率化を促進すべ
きである。(とりまとめP16~17)
12
GCP改正の背景
• 被験者の人権の保護、安全の保持及び福祉の向上を図り、治験の科学的な質及び成績の信頼性を確
保するため、医薬品の臨床試験の実施に係る基準(GCP省令)を定めている。
• GCP省令は国際的な基準であるICH-GCP を法制化したものであるが、近年ICH-GCPについて、臨
床試験環境の急速な進歩がガイドラインに反映されていないことや、Proportionalityが欠如し、臨
床試験への「画一的(one-size-fits-all)」なアプローチになっていること等が指摘されてきた。
• これを受けて、ICH-GCPが2025年1月に改定について合意され、試験の質に関する重要な要因に
焦点を当て、想定されるリスクや目的に適合したアプローチを促進することされたため、日本にお
いても速やかに実装していく必要がある。
• また、ドラッグ・ロスの要因の一つとして、国際共同治験において、日本人症例の組入れが遅い等
の理由により、日本を避ける傾向が指摘されている。令和6年度より治験エコシステム導入推進事
業を実施し、国内で治験を実施しやすい環境作りのため、国内治験にかかるコストの削減や手続き
の負担の解消のため、医療機関における負担の実態調査や関係業界を交えた検討を進めてきた。
制度部会とりまとめの記載
•
GCP適合性調査について、リスクに応じた調査実施の合理化や、治験施設支援機関(SMO)に対す
る治験依頼者の監督強化を図るほか、GCP Renovation の一環である医薬品規制調和国際会議
(ICH)による「ICH-E6(R3)医薬品の臨床試験の実施に関する基準のガイドライン」の実装も見
据えて、臨床試験の質に関する重要な要因に対するリスクに応じた管理の実施といった新しい考え
方を積極的に導入するなど、治験に携わる従事者の負担軽減を含め治験の更なる効率化を促進すべ
きである。(とりまとめP16~17)
12